Kostenlos: der ÄFI-Newsletter
Bleiben Sie auf dem Laufenden beim Thema
Impfungen & Impfentscheidung und rund um den Verein.
COVID-19
(SARS-CoV-2)
Welche Altersgruppe ist durch COVID-19 am meisten gefährdet? Welche Risikofaktoren gibt es für die Erkrankung? Für wen hat die STIKO eine Impf-Empfehlung ausgesprochen? Welche Impfnebenwirkungen treten am häufigsten auf? Und wieso setzt sich der Verein für eine Rücknahme der Impf-Empfehlung für unter 60-Jährige ein? Antworten auf diese und weitere Fragen finden Sie im nachfolgenden Fachbeitrag.
Vorbemerkung
Die folgenden Ausführungen dienen der Information und ersetzen keinesfalls das ärztliche Beratungsgespräch. Hier werden Fakten präsentiert, die Eltern wie auch Ärztinnen und Ärzten in einem Aufklärungsgespräch helfen können. Wenn nicht anders angegeben, stammen die Aussagen vom epidemiologischen Steckbrief des RKI für SARS-CoV-2 (Robert Koch-Institut, 2021). Ärztinnen und Ärzte für individuelle Impfentscheidung e. V. (ÄFI) übernimmt keine Garantie für Vollständigkeit, hat die hier verfügbaren Inhalte jedoch nach bestem Wissen und Gewissen am aktuellen Fach- und Sachstand zusammengetragen. Über die wissenschaftliche Arbeit des Vereins erfahren Sie hier mehr. Der Fachbeitrag wird halbjährlich aktualisiert. Das dargelegte Wissen entspricht dem Kenntnisstand zum angegebenen Veröffentlichungs- bzw. Aktualisierungsdatum. Weitere Informationen erhalten Sie auch in unserem Podcast.
Im Podcast anhören
Fachbeitrag
- COVID-19: Die Erkrankung
Erreger
- Der Erreger von COVID-19 ist SARS-CoV-2 (severe acute respiratory syndrome coronavirus type 2), ursprünglich 2019-nCoV genannt.
- SARS-CoV-2 zählt zu den Beta-Coronaviren, zu denen auch SARS-CoV und MERS-CoV gehören. Humane Coronaviren (HCoV), mit denen sich Menschen infizieren können und zu denen z. B. auch SARS-CoV-1 gehört, verursachen vor allem grippeähnliche Symptome, manchmal auch schwere Lungenentzündungen.
- Wie von einigen Forschern 2020 vermutet, besteht eine Kreuzreaktivität zwischen verschiedenen Coronaviren. Das haben Forscher des Universitätsklinikums Hamburg-Eppendorf 2023 durch den Nachweis einer breiten T-Zell-Antwort des Immunsystems auf die RNA-abhängige RNA-Polymerase von SARS-CoV-2 in Blutproben von COVID-Patienten sowie von Probanden, die nie mit SARS-CoV-2 infiziert waren, bestätigt (Westphal et al., 2023).
Infektionsmodus
- Infektion durch Tröpfchen & Aerosole
- Respiratorische Aufnahme z. B. beim Atmen, Niesen, Husten, Sprechen, Singen
- Manifestationsindex zwischen 55-85
- 3-4 Tage Inkubationszeit – für Kinder ist sie etwas kürzer, für ältere Menschen etwas länger (Wu et al., 2022)
Besorgniserregende Varianten (VOCs)
- Seit dem ersten Auftreten von SARS-CoV-2 im Jahr 2019 sind verschiedene Virusvarianten aufgetreten. Die Gliederung in Virusvarianten basiert auf Veränderungen des Genoms, das im Vergleich zur vorherigen Variante zu veränderten Eigenschaften des Virus führt – z. B. kann die Übertragbarkeit höher oder geringer sein, oder der Krankheitsverlauf schwerer bzw. leichter. Es kann aber auch zu unbemerkten Veränderungen kommen, die keinen oder nur geringen Einfluss auf die Viruseigenschaften und das Infektionsgeschehen haben.
- Sobald Veränderungen beobachtet werden, wird eingeschätzt, ob es sich um besorgniserregende Veränderungen handelt (z. B. Veränderungen der Immunkontrolle, Virulenz, Nachweisbarkeit oder höhere Übertragbarkeit). Werden die Veränderungen als besorgniserregend eingestuft, wird die Variante als „variant of concern“ (VOC), also besorgniserregende Variante erfasst. VOC entstehen meistens durch Veränderungen des Spike-Proteins, da dies die Hauptbindungsstelle des Virus ist.
- Ist unklar, welchen Einfluss die Veränderungen auf das Infektionsgeschehen haben, wird die Variante als „variant of interest“ (VOI) weiter beobachtet.
Bisher identifizierte VOCs und ihre Eigenschaften:
B1.1.7 (Alpha), seit Mitte Dezember 2020, zuerst in Großbritannien identifiziert
- Etwa 50 % übertragbarer als das Ursprungsvirus
- Leicht erhöhte Sterblichkeit
B.1.351 (Beta), seit Oktober 2020, zuerst in Südafrika identifiziert
- Stärkere Bindung an ACE-2-Rezeptor → schlechtere Erkennbarkeit für Antikörper → schlechtere Neutralisation bei Genesenen
- Ggf. höhere Übertragbarkeit
- Entzieht sich am stärksten der immunisierenden Wirkung der Impfungen
B.1.1.28 (Gamma), auch P.1.-Variante, zuerst in Brasilien identifiziert
- Ggf. höhere Übertragbarkeit
- Impfstoff ähnlich wirksam wie bei Alpha-Variante
B.1.617.2 (Delta), sei Mai 2021, zuerst in Indien identifiziert
- Erhöhte Übertragbarkeit
- Erhöhte Hospitalisierung
- Reduzierte Wirksamkeit der Impfung
B.1.429 (Epsilon), seit Juli 2020, zuerst in USA identifiziert
- Ggf. übertragbarer
- Ggf. Immunflucht
B.1.525 (Eta), seit Dezember 2020, zuerst in Großbritannien und Nigeria identifiziert
- Ggf. schlechtere Immunantwort und schlechtere Wirksamkeit der Impfstoffe
B.1.1.529 (Omikron), seit November 2021, zuerst in Südafrika identifiziert
- Erhöhte Übertragbarkeit
- Ggf. erhöhte Reinfektion
- Ggf. schlechtere Wirkung der Impfung/durchgemachter Infektionen
- Ggf. schlechtere Behandlungsergebnisse mit therapeutischen monoklonalen Antikörpern
Seitdem sind Omikron-Sublinien und Rekombinanten dominant. Unter Rekombinanten sind neugebildete Subtypen zu verstehen. XBB.1 ist wohl aus den Omikron-Sublinien BJ.1 und BA.2.75 entstanden (Robert Koch-Institut, 2023b). Rekombinanten (sowie deren Sublinien wie XBB.1.5) sind in ihren Eigenschaften mit Omikron zu vergleichen, weisen jedoch laut vorläufigen Daten einen Übertragungsvorteil und noch deutlichere Immunfluchteigenschaften auf (Robert Koch-Institut, 2023b).
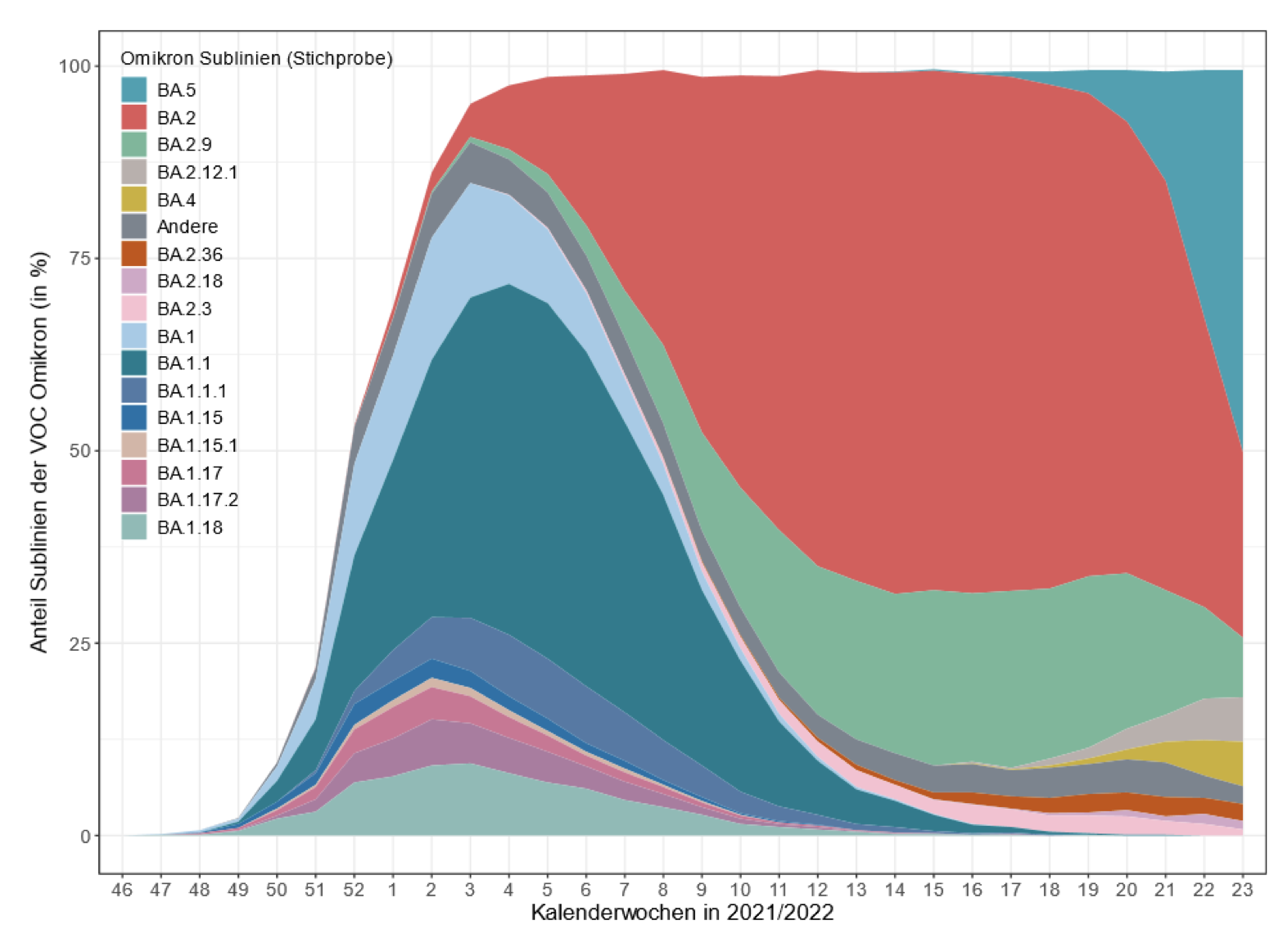
- BA.2 vorkommend seit Januar 2022, dominant mit bis zu 98 % (April 2022), dann Rückgang bis Anfang Juni 2022 auf 41 %, Ende Juni 2022 nur noch 10 %,
- BA.4 kommt nie auf mehr als 7 % (Juni 2022)
- BA.5 ist seit Juni 2022 dominant (52 %) und hat BA.2 verdrängt (41 %) (Robert Koch-Institut, 2022b).
- BQ1.1, medial auch als „Höllenhund“ bezeichnet, breitete sich seit November 2022 aus und erreichte am 1. Januar 2023 etwa 26 %, in KW9/10 lag sie nur noch bei 5 % (Robert Koch-Institut, 2023b). Entgegen aller öffentlichen Befürchtungen unterschied sich auch diese Subline nicht im Vergleich zu anderen Omikron-Varianten hinsichtlich des Schweregrads der Erkrankung bei der Aufnahme in die Intensivstation, der Notwendigkeit einer Unterstützung bei Organversagen während des Aufenthalts auf der Intensivstation und der Sterblichkeit am Tag 28 nicht von anderen Omikron-Varianten wie BA.2 und BA.4/BA.5 (de Prost, 2023).
- Im Februar 2023 hat die Rekombinante XBB.1 (46 %) die Omikron-Sublinie BA.5 verdrängt (20 %) und lag dann (März 2023) bei 61,4 %. Der Anteil der Variante BA.4 wird seit Februar 2023 mit 0 % angegeben, BA.2 wurde demgegenüber mit bis zu 23 % (Februar 2023) wieder vermehrt nachgewiesen (Robert Koch-Institut, 2023b).
Der letzte Wochenbericht zu COVID-19 ist am 8. Juni 2023 erschienen, seitdem wird in den ARE-Wochenberichten (spärlich) über aktuell zirkulierende VOCs durch das RKI informiert.
- Im ARE-Wochenbericht für Kalenderwoche 36 (4. bis 9. September 2023) werden XBB.1.16 („Arkturus“) und EG.5 („Eris“) mit jeweils knapp 23 % als relevante VOCs aufgeführt. Variante BA.2.86 („Pirola“) wurde in Kalenderwoche 34 (21. Bis 28. August 2023) erstmals nachgewiesen (Robert Koch-Institut, 2023e). Es gibt weiterhin keinen Grund zu der Annahme, dass bei den genannten Varianten eine klinische Auffälligkeit im Vergleich zu anderen zirkulierenden oder vergangenen Omikron-Sublinien und Rekombinanten besteht (Abbasi, 2023; Karyakarte et al., 2023; Mahase, 2023; Rasmussen et al., 2023).
Abbildung 1: Prozentuale Anteile der vom RKI erfassten Omikron Sublinien bezogen auf die Genomsequenzen der Stichprobe vom 15. November 2021 bis 12. Juni 2022 (Robert Koch-Institut, 2022a). Zur Vergrößerung Bild anklicken.
Abbildung 2: Prozentuale Anteile der SARS-CoV-2-Sublinien und Rekombinanten bezogen auf die Genomsequenzen der Stichprobe vom 12. September 2022 bis 12. März 2023 (Robert Koch-Institut, 2023b). Zur Vergrößerung Bild anklicken.
Infektionsverlauf
- Das Krankheitsbild hat sich im Lauf der Pandemie mit der Variantenvielfalt gewandelt. Waren es anfänglich weniger, dafür aber oft schwerer erkrankte Menschen, gab es gegen Ende eher mehr symptomatisch erkrankte Menschen mit insgesamt milderen Verläufen.
- „Mit dem Alter nimmt die Wahrscheinlichkeit für einen schweren Verlauf immer weiter zu” (s. auch Infektionssterblichkeit). Für die Ansteckungsfähigkeit ist dies nicht abschließend geklärt, hohes Alter wird jedoch als unabhängiger Risikofaktor für die längere Ausscheidung von SARS-CoV-2-RNA angesehen (Pezzullo et al., 2023).
- Die Ansteckungsfähigkeit bei einem leichten bis mittelschwerem Verlauf wird auf etwa 10 Tage geschätzt. Bei schweren Verläufen kann sie länger andauern.
- Die sekundäre Befallsrate (SAR) liegt für Omikron bei etwa 30-40 % (Del Águila-Mejía et al., 2022; Lyngse et al., 2022).
- Der Krankheitsverlauf kann von asymptomatisch bis schwer und sogar tödlich variieren. Der gepoolte Anteil asymptomatischer COVID-19-Verläufe wird auf 32,4 bzw. 40,5 % unter Omikron geschätzt (Ma et al., 2021; Shang et al., 2022). Dabei weisen Kinder- und Jugendliche einen höheren Anteil an asymptomatischen Infektionen auf (Yu et al., 2022).
- In den meisten Fällen kommt es zu grippeähnlichen Symptomen (Bundeszentrale für gesundheitliche Aufklärung, 2022).
- Die Inkubationszeit wird häufig auf etwa 6 Tage geschätzt (Del Águila-Mejía et al., 2022).
- Die häufigsten Symptome sind Husten, Schnupfen, Fieber, Geruchs- und Geschmacksverlust.
- Weitere Symptome sind Kopf- und Gliederschmerzen, Halsschmerzen, Appetitlosigkeit, Atemnot, Übelkeit, Durchfall und Schwellung der Lymphknoten.
Komplikationen
Die folgenden Komplikationen können zusätzlich zu oder nach schweren Verläufen auftreten:
Kardiovaskuläre Erkrankungen
z. B. Myokarditis, Perikarditis, Herzrhythmusstörungen, Myokardschädigungen u. Ä.
- Biomarker von kardiovaskulären Erkrankungen, die mit COVID-19 in Verbindung stehen und die Sterblichkeit prognostizieren können, sind die D-Dimere, die CK-MB, das Troponin T und I sowie das IL-6 (Shoar et al., 2020).
- Ein systematisches Review mit Meta-Analyse kommt zu dem Schluss, dass Myokarditis und Herzrhythmusstörungen die häufigsten kardiovaskulären Erkrankungen bei COVID-19-Patienten sind. Die Inzidenz von Myokardverletzungen und Herzversagen sei bei Nicht-Überlebenden höher als bei Überlebenden (Zhao et al., 2021).
- Ein kollaboratives systematisches Review von Almamlouk et al. (2022) diskutiert demgegenüber Auswahl- und Berichtsverzerrungen bezüglich Autopsie- und Bildgebungsstudien zur Bestimmung der Prävalenz von Myokarditis durch COVID-19. Die meisten Studien gaben nicht an, welche Definition genutzt wurde. Die Autoren folgern insgesamt eine geringere Inzidenz als in der allgemeinen Literatur angeführt (Almamlouk et al., 2022).
- In einer israelischen retrospektiven Kohortenstudie mit fast 200.000 Erwachsenen und einer fast 600.000 Erwachsene umfassenden Kontrollkohorte wurde festgestellt, dass bei ungeimpften Patienten, die sich von einer COVID-19-Infektion erholen, keine erhöhte Inzidenz an Myokarditis und Perikarditis beobachtet werden kann. Es wurden nur Diagnosen zehn Tage nach einem positiven SARS-CoV-2-Testergebnis einbezogen und eine limitierte Anzahl an Diagnosecodes verwendet (Tuvali et al., 2022).
Zur Diskussion über die Häufigkeit von kardiovaskulären Komplikationen nach Infektion im Vergleich zur Impfung findet sich mehr unter „COVID-19: Die Impfung“.
Thrombosen
- Durch eine vermehrte Blutgerinnung bis hin zur Blutgerinnungsstörung kann es zu Thrombosen kommen (Zuin et al., 2021).
- Die Prävalenz von venösen thromboembolischen Ereignissen (VTE) bei Patienten mit einem schweren COVID-19-Verlauf, die im Krankenhaus behandelt werden müssen, wird in einem systematischem Review mit Meta-Analyse mit 20,7 % angegeben. VTE traten besonders häufig bei mechanisch beatmeten Patienten auf, jenen Patienten, die auf die Intensivstation aufgenommen werden mussten, und Patienten mit einem niedrigen PaO2/FiO2-Verhältnis (P/F-Verhältnis). Chronische Begleiterkrankungen wie kardiovaskuläre Erkrankungen oder Herzversagen erhöhten das Risiko jedoch nicht. Marker für das Auftreten von VTE sind: eine höhere Leukozytenzahl und höhere Werte von D-Dimer, C-reaktivem Protein und Procalcitonin (Agarwal et al., 2022).
- Ein systematisches Review mit Meta-Analyse gibt die Gesamthäufigkeit für ambulante und poststationäre Patienten mit venösen Thromboseereignissen nach COVID-19-Infektion mit 0,8 % (0,28 bzw. 1,16 %) an. Für arterielle Thromboseereignisse lag dieser Wert bei 0,75 % (0,23 bzw. 1,45 %). Die Autoren folgern, dass es ein geringes Risiko für venöse und arterielle Thrombosen bei COVID-19-Patienten außerhalb des Krankenhauses gibt und daher hier wahrscheinlich keine universelle Thromboseprophylaxe notwendig sei (Mansory et al., 2022).
Nierenversagen
- Die Entwicklung einer akuten Nierenschädigung bzw. eines -versagens (ANV) im Rahmen eines schweren COVID-19-Verlaufs verschlechtert die Prognose des Patienten erheblich. Meist entsteht ANV durch systemische Immunreaktionen wie die Immunthrombose oder durch einen zytopathischen Effekt bei älteren Menschen mit Komorbiditäten (Chebotareva et al., 2021).
- In einem systematischen Review mit Meta-Analyse mit 29 inkludierten Studien und 15.017 bestätigten COVID-19-Fällen wird die Gesamtprävalenz von ANV auf 11,6 % geschätzt (Singh et al., 2022). Ein weiteres systematisches Review mit Meta-Analyse kommt mit 10,08 % auf ein ähnliches Ergebnis (Nasiri et al., 2021).
- Die häufigsten Komorbiditäten für ANV bei COVID-19-Patienten sind Diabetes, Bluthochdruck und Hyperlipidämie (Sabaghian et al., 2022).
Hyperinflammationssyndrom
- Bisher werden uneinheitliche Kriterien zur Definition verwendet, meist wird das Syndrom als schwere Entzündung mit Zytokin-Sturm verstanden und war vor allem in den ersten drei Wellen (Wuhan-Typ, Alpha- und Delta-Variante) eine Komplikation mit Hinweis auf einen nachfolgend schweren Verlauf mit intensivmedizinischer Behandlung. Häufig werden entzündungshemmende Medikamente zur Behandlung gegeben, die bei Hyperinflammationssyndrom infolge von COVID-19 jedoch weniger wirksam sind (Hasan et al., 2022).
- Das Hyperinflammationssyndrom trägt entscheidend zur Schwere der Erkrankung und zur Sterblichkeit bei COVID-19 bei. Derzeit wird als Ursache das dysregulierte angeborene Immunsystem des Wirts angenommen (Gustine & Jones, 2021).
- Folgen sind Gewebeschäden, akutes Atemnotsyndrom (ARDS) und Multiorganversagen (Tan et al., 2021).
- Die Häufigkeit des durch COVID-19 ausgelösten Hyperinflammationssyndroms ist letztlich nicht genau bekannt (Feldt et al., 2020).
Long-Covid und Post-Covid
- Long-Covid und Post-Covid sind Sammelbegriffe für komplexe und heterogene Folgeerscheinungen nach COVID-19. Diese sind in ihrer Art, Häufigkeit und Ätiologie jedoch nur unzureichend beschrieben (Michelen et al., 2021).
- Hinsichtlich der Pathogenese herrscht Unklarheit. Es wird angenommen, dass es zu einer länger anhaltenden Immunantwort durch Interferone, Zytokine und aktivierte T-Zellen kommt, wodurch eine Entzündungssituation entsteht. Weitere Studien kommen zu dem Ergebnis einer endothelialen Dysfunktion und beeinträchtigter Mikrozirkulation oder zu einer vermehrten Aktivität von Autoantikörpern (Scheibenbogen et al., 2023).
- Eine neuere dänische Kohortenstudie konnte jedoch keine generelle Schwächung des Immunsystems nach einer Corona-Infektion feststellen (Andersson, 2023).
- Das britische National Institute for Health and Care Excellence (NICE), das vergleichbar mit dem deutschen Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWIG) ist, definiert Long-Covid als „Anzeichen und Symptome, die während/nach der COVID-19-Infektion auftreten und länger als 4 Wochen andauern und nicht durch eine andere Diagnose erklärt werden können“. Bei einem Zeitraum, der länger als 12 Wochen andauert, solle dann vom Post-COVID-Syndrom gesprochen werden. Andere Forscher kritisieren diese Definition jedoch für ihre „obskuren Ausschlusskriterien“ (Akbarialiabad et al., 2021).
- Als häufigste Symptome werden bei Akbarialiabad et al. (2021) Müdigkeit, Atemnot, Gelenkschmerzen, Schlafstörungen und Brustschmerzen genannt (Akbarialiabad et al., 2021). Bei Lopez-Leon et al. (2021) sind es Müdigkeit (58 %), Kopfschmerzen (44 %), Aufmerksamkeitsstörungen (27 %), Haarausfall (25 %) und Kurzatmigkeit bzw. Atemnot (24 %) (Lopez-Leon et al., 2021).
- Ein im November 2022 veröffentlichtes systematisches Review mit Meta-Analyse von 12 Monate andauernden Follow-up-Studien und insgesamt 8.591 Teilnehmern stellte eine etwas andere Prävalenz sowie Symptome bei Betroffenen fest: Müdigkeit/Schwäche (28 %), Atemnot (18 %), Arthromyalgie (26 %), Depression (23 %), Angstzustände (22 %), Gedächtnisverlust (19 %), Konzentrationsstörungen (18 %) und Schlaflosigkeit (12 %) (Chen et al., 2022).
- Frauen mit einer schweren Ersterkrankung scheinen dabei häufiger unter Folgeerscheinungen durch COVID-19 zu leiden (Han et al., 2022).
- Eine Kohortenstudie, die in der Fachzeitschrift JAMA Network (herausgegeben von der American Medical Association) publiziert wurde, mit 382 SARS-CoV-2-positiven Personen und einer Kontrollgruppe von 85 SARS-CoV-2-negativen Personen im Alter von 12 bis 25 Jahren fand bei einer Nachuntersuchung nach 6 Monaten eine etwa gleichgroße Häufigkeit an Post-Covid-Symptomen: 48,5 % (SARS-CoV-2-positiv) bzw. 47,1 % (Kontrollgruppe). Bei Jugendlichen und jungen Erwachsenen war Post-Covid dementsprechend nicht mit einer SARS-CoV-2-Infektion assoziiert. Die Ausprägung von Symptomen war vor allem von Einsamkeit bzw. psychosozialen Faktoren sowie körperlicher Arbeit abhängig. Das wirft laut den Autoren Fragen zur Falldefinition der WHO auf und zu Ergebnissen von Meta-Analysen, die Post-Covid auf eine Häufigkeit von 32-62 % schätzen (Selvakumar et al., 2023).
- Ähnliche Ergebnisse fanden sich auch in einer norwegischen Kohortenstudie, publiziert im Fachjournal nature, mit 2,3 Mio. Teilnehmern im Alter von 18-70 Jahren: Long-Covid wurde nur geringfügig mehr in der Gruppe mit COVID-19-Infektion beobachtet als in der Gruppe ohne COVID-19-Infektion (Magnusson et al., 2023).
- Eine bisher nur als Preprint erschienene Studie mit Daten aus Australien verglich COVID-19-geimpfte Erwachsene 12 Wochen nach einer PCR bestätigten Omikron-COVID-19- oder Influenza-Infektion. In der COVID-19-Kohorte befanden sich 2.195 Teilnehmer, in der Influenza-Kohorte 951. Die statistische Auswertung ergab keinen Unterschied zwischen den beiden Gruppen in Hinsicht auf die Häufigkeit anhaltender Symptome (21,4 % vs. 23 %) oder mäßige bis schwere Funktionseinschränkungen (4,1 % vs. 4,4 %). Bei der weiteren Erforschung von Long-COVID empfehlen die Autoren die Nutzung geeigneter Vergleichsgruppen, da diese in bisherigen Studien oft fehlten (Brown et al., 2023).
- Während eine schwere COVID-19-Infektion häufiger zu Folgeerscheinungen führt, kann auch ein milde Infektion zum Long-Covid-Syndrom führen. Eine Registerstudie aus Norwegen deutet jedoch darauf hin, dass das Risiko dafür höher ist, wenn vor der Infektion psychische (OR = 2,12, 95% CI 1,84–2,44), respiratorische (OR = 2,03, 95% CI 1,78–2,32) oder allgemeine und nicht spezifizierte Gesundheitsprobleme (OR = 1,78, 95% CI 1,52–2,09) diagnostiziert wurden. Von 214.667 Studienteilnehmern wurde bei etwa 908 (0,42 %) ein Long-COVID-Zustand festgestellt. Ein höheres Risiko wird immer wieder auch bei Frauen, insbesondere mit einer schweren Erst-Erkrankung, festgestellt und bei Menschen, die sich mit dem ursprünglichen Wuhan-Virus infiziert haben (Han et al., 2022; Reme et al., 2023).
- Real-World-Daten der AOK mit 2,3 Millionen Versicherten legen nahe, dass die Schwere und Häufigkeit von Long- bzw. Post-COVID abnimmt, da nach der Delta-Variante etwa 2,5 % der Infizierten unter Folgeerscheinungen litt, während es unter Omikron nur noch 1,1 % waren. Die durchschnittliche Dauer der Arbeitsunfähigkeit betrug dabei 43,2 bzw. 30,9 Tage (Wissenschaftliches Institut der AOK, 2023).
- Die globale Prävalenz von Folgeerscheinungen durch COVID-19 (> 4 Wochen) wird laut einem systematischen Review mit Meta-Analyse auf 43 % geschätzt (Chen et al., 2022). Ein weiteres Review von 2023 gibt eine Spanne zwischen 9 und 63 % an Long-COVID Betroffenen nach Infektion an (Lippi et al., 2023). Allerdings kann hier auch von „obskuren Einschlusskriterien“ gesprochen werden: Für diese Prävalenz(spanne) ist lediglich das Vorhandensein von einem Symptom notwendig, dessen Schweregrad nicht von Bedeutung ist und bei dem häufig auch kein kausaler Zusammenhang hergestellt werden kann. Hinzu kommt, dass häufig lediglich Online-Fragebögen zur Erfassung von Symptomen genutzt werden.
- Andere Forscher kommen dagegen zu dem Schluss, dass das Postvirale Syndrom (Long-COVID/Post-COVID) nicht häufiger als nach anderen Atemwegserkrankungen auftritt (Vivaldi, 2023).
- Erbguth, Frank & Kleinschnitz kritisieren in einem Artikel im Ärzteblatt, dass es hinderlich sei, Long-COVID rein biologisch auffassen zu wollen. Seit der Einführung der Medizintheorie des biopsychosozialen Modells sei zunehmend verstanden worden, dass jede Erkrankung psychosoziale Implikationen hat. Den Einfluss psychosozialer Faktoren bei Long-COVID abzulehnen (etwa den Einfluss der Psychosomatik), führe zu einer reduktionistischen Sichtweise, die bei der weiteren Erforschung der Erkrankung und geeigneten Therapiemöglichkeiten hinderlich sei (Erbguth et al., 2023).
- Medial wird immer wieder von Personen berichtet, die auf eigene Kosten eine Blutwäsche (Plasmapharese) nach Long-Covid-Erkrankung (oder auch Post-Vac-Syndrom) haben durchführen lassen. Ziel einer solchen Behandlung ist häufig, „Mikro-Blutgerinnsel“ zu entfernen, indem das Blut aus dem Körper entnommen und die Plasmakomponente des Blutes durch eine Maschine gefiltert wird. In einem hochwertigen Cochrane-Review zu diesem Thema wurde die vorhandene Evidenz ausgiebig geprüft. Die Autoren konstatieren zum einen, dass amyloide Fibrin(ogen)partikel der angemessenere Begriff als „Mikro-Blutgerinnsel“ ist (da es sich nicht um Gerinnsel handelt). Zum anderen, dass keine Plasmapharese bei Long-Covid außerhalb von RCTs durchgeführt werden sollte, da bisher keine Evidenz zu dieser Therapie vorliegt. Bisher ist auch noch nicht bewiesen, ob Amyloid‐Fibrin(ogen)‐Partikel überhaupt zur Entstehung der Erkrankung beitragen (Fox et al., 2023).
Weiterführende Informationen erhalten Sie im Arbeitspapier von ÄFI: Strategien zur Diagnostik und Therapie von Long-COVID und Post-Vac-Syndrom. Bitte lesen Sie dazu hier weiter.
COVID-19 bei Kindern
In der ambulanten Pädiatrie ist COVID-19 grundsätzlich sehr selten. Spätestens seit der Co-Ki-Studie von 2021 ist klar: Kinder haben weder ein besonderes Risiko an COVID-19 zu erkranken noch stellen sie eine relevante Infektionsquelle dar (Schwarz et al., 2021). Während der COVID-19-Pandemie kam es jedoch immer wieder zu Diskussionen über die Rolle von Kindern und Jugendlichen (sowie KiTas und Schulen) als Infektionsquelle.
- Eine 2021 veröffentlichte und medial stark hervorgehobene Studie hatte eine ähnliche Viruslast bei Kindern und Erwachsenen gemessen und daraus gefolgert, dass Kinder so ansteckend wie Erwachsene seien könnten (Jones et al., 2021).
- Eine 2022 veröffentlichte retrospektive Querschnitts-Kohortenstudie zeigte jedoch ein ganz anderes Ergebnis auf: dass die virale Last mit dem Alter zunimmt (Euser et al., 2022).
- Eine 2023 veröffentlichte Studie, die einen sogenannten Resp-Aer-Meter zur Messung der Aerosol-Konzentration genutzt hat, fand schließlich heraus, dass Kinder und Jugendliche grundsätzlich weniger Aerosol-Teilchen ausscheiden als Erwachsene. Außerdem gab es in der Studie keinen einzigen Superspreader unter Kindern und Jugendlichen – also Menschen, die 5000 Teilchen pro Liter ausatmen und damit viele andere Personen infizieren (Schuchmann et al., 2023).
Bei Kindern sollte außerdem zwischen zwei Gruppen differenziert werden:
Ungeborene und Neugeborene
- häufigeres Auftreten von Präeklampsie und Frühgeburtlichkeit im Zusammenhang mit zusätzlich anderen medizinischen Einflüssen
- Kinder sind nicht wesentlich gesünder oder ungesünder
- Keine erhöhte Mortalität der Mütter
(Klein-)Kinder
- Die Studienlage ist laut RKI in der Summe inkonsistent
- Risikofaktoren sind Alter < 1 Monat, Vorerkrankungen und Anzeichen einer Infektion der unteren Atemwege
- Mögliche Komplikation im Kindesalter: PIMS
- COVID-19 hatte insgesamt keinen Einfluss auf die Mortalität in der Altersgruppe der unter 5-Jährigen (Takefuji, 2023).
- Die Datenlage zu Long-Covid/Post-Covid liefert im Kindesalter keine Hinweise auf einen Zusammenhang zwischen einer Infektion und Post-Covid-Symptomen (Hirt et al., 2022; Stephenson et al., 2022; Dun-Dery, 2023).
Therapie
Ambulante Behandlung
- Die in der Frühphase einzusetzende Budesonid-Inhalation hatte in England zu sehr guten Ergebnissen im Vermeiden von Hospitalisierungsnotwendigkeit geführt (Ramakrishnan et al., 2021). Dies hatte wohl auch alle DEGAM-Leitlinien-Mitglieder überzeugt: Insgesamt stimmten sie zu 100 Prozent für diese Therapie bei beginnender Atemnot zur ambulanten Therapie, auch um die Ressourcen in den Kliniken zu schonen und die Belüftungsstörungen der Lungen bei den PatientInnen zu reduzieren. Die restlichen Gesellschaften waren sich bei einer Enthaltung nicht einig (4 dafür und 5 dagegen). Mit diesem Abstimmungsergebnis wurde diese Therapie dann nicht in die Empfehlungen der S2e-Leitlinie aufgenommen (Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin e.V. et al., 2023).
- Das viel diskutierte Vitamin D3 soll nach Dafürhalten der 16 stimmberechtigten Mitgliedschaften der AWMF-Leitlinie weder akut noch chronisch zur Therapie eingesetzt werden. Es hätten sich in den in der Leitlinie zitierten Studien keine Vor-, aber auch keine Nachteile unter der ergänzenden Therapie mit Vitamin D3 ergeben. Bei nachgewiesenem Mangel oder bei hochaltrigen PatientInnen in Alten- und Pflegeheimen sei eine Substitutionstherapie mit 1000-2000IE täglich jedoch überlegenswert und sinnvoll zu ergänzen (Corona Mediziner Allianz, 2023; Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin e.V. et al., 2023).
- Unterstützende Maßnahmen in der Rekonvaleszenzphase stellen neben allgemeiner Ruhe auch ausreichende Flüssigkeitsaufnahme und frische Luft zur Aufrechterhaltung des Herz-Kreislaufsystems und leichte Bewegung, wenn wieder möglich, dar. Auf eine sportliche Betätigung sollte noch bis zu 2-3 Wochen nach Infektion verzichtet werden.
- Eine Behandlung von Koinfektionen hat in jeder Stufe eine Relevanz und sollte zielgerichtet erfolgen (z. B. antibiotische Begleittherapie bei Superinfektionen, Behandlung von Pilzinfektionen).
Stationäre Behandlung
- Angepasst an den Verlauf und die Schwere der Erkrankung werden in einem Stufenschema unter anderem mit zunehmender Schwere des Verlaufs der Erkrankung durchgeführt: Allgemein immunsuppressive Therapie mit hochdosierten Kortison-Gaben, blutverdünnende Therapie mit hochdosierter nieder-molekularer Heparinisierung bei D-Dimererhöhung, Aufrechterhaltung der SpO2-Sättigung durch eine adäquate Sauerstoffzufuhr und ECMO-Beatmung. Aktuell sind laut DIVI-Tagesreport 330 Patienten bundesweit wegen COVID-19 konventionell beatmet (Deutsche Interdisziplinäre Vereinigung für Intensiv- und Notfallmedizin (DIVI) e.V. & Robert Koch-Institut, 2023), in den Hochzeiten der Pandemie waren es bis zu 3500 PatientInnen, die zeitgleich in Deutschland beatmet wurden.
- Die Gabe von monoklonalen Antikörpern wie SotrovImab oder deren Vorgängern in der Frühphase der Erkrankung hatte bei den ursprünglichen Varianten einen ansprechenden Erfolg bei schweren Verläufen, ist zum gegenwärtigen Pandemiestand aber ausdrücklich nicht mehr zu empfehlen, da die Übereinstimmung mit der BA.4 und BA.5 - und vor allem bei der zunehmenden XBB.1-Variante der Omikron-Linie - gegen Null geht (Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin e.V. et al., 2023).
- Antivirale Arzneimittel wie beispielsweise das Remdesivir sind schon durch ihre Applikationsform (i.v. Gabe über eine Stunde) hausärztlich nur schwer durchführbar und auch im stationären Setting (nur in spezialisierten Einheiten empfohlen) durch eine enggestellte Indikation nur bestimmten Personengruppen (Schwere des Verlaufes, innerhalb der ersten sieben Tage) vorbehalten und somit nur selten wirklich zum Einsatz gekommen. Der Nutzen sei bei alledem nicht sicher geklärt (Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin e.V. et al., 2023).
- Zu einem ähnlichen Beschluss kommt die Kommission bei Molnupiravir. Hier soll zudem über den Ausschluss einer Schwangerschaft und vor allem hinsichtlich der Teratogenotoxizität dieser Arznei aufgeklärt werden.
- Andere Arzneien finden keinen direkten Widerhall in der Empfehlungsgüte der AWMF-Leitlinien-Experten.
Wer sich über die Grenzen Deutschlands hinaus über diskutierte Therapieoptionen informieren möchte, kann dies auf der Website der FLCCC Alliance tun.
Prognose
- Die gemittelte Infektionssterblichkeit (IFR) wurde laut einem 2022 veröffentlichten systematischen Review mit Meta-Analyse unter Mitwirkung von John P. A. Ioannidis mit 0,0003 % für 0-19 Jahre, 0,002 % für 20-29 Jahre, 0,011 % für 30-39 Jahre, 0,035 % für 40-49 Jahre, 0,123 % für 50-59 Jahre und 0,506 % bei 60-69 Jahre alten Menschen berechnet. Der Median der IFR für 0-59 Jahre betrug demnach 0,034 %, für 0-69 Jahre 0,095 %. Damit steigt die Infektionssterblichkeit etwa alle zehn Jahre um das Vierfache. Die großen Unterschiede einzelner Länder führen die Autoren auf Komorbiditäten und andere Faktoren zurück (Pezzullo et al., 2023). Erste Schätzungen der IFR in Deutschland wurden durch die Case-Cluster-Studie in der Gemeinde Heinsberg im Mai 2020 möglich. Das Forscherteam um Streeck et al. stellte eine hohe Dunkelziffer an Infizierten fest und kam so auf eine altersstandardisierte IFR von 0,35 % für die ursprüngliche Wuhan-Variante (Streeck et al., 2020).
- Das RKI gibt bezüglich der Fallsterblichkeit (CFR) an, dass das Risiko, zu versterben, mit dem Alter ansteigt und bei Menschen über 80 Jahren (10-30 % Letalität) am höchsten ist, während es bei den Jüngsten nahezu 0 % beträgt. Insgesamt seien etwa 1,8 % der an der Infektion Erkrankten verstorben. Eine Meta-Analyse zur globalen CFR vom Juli 2021 kommt bei der generellen Bevölkerung auf einen geringeren Wert von 1 % (Alimohamadi et al., 2021). Durch die reduzierte Pathogenität der Omikron-Variante ist noch einmal von einer geringeren CFR auszugehen (Kim et al., 2023).
- Eine Studie unter Mitwirkung von John P. A. Ioannidis & Hendrick Streeck hat Totenscheine in einer Gemeinde mit einem Superspreader-Event geprüft und herausgefunden, dass die Zahl der von den nationalen Behörden angegebenen COVID-19-bedingten Todesfälle um etwa 25 % höher liegen dürfte als die tatsächlich kausalen COVID-19-Todesfälle, da diese nicht den Definitionen der WHO genügten (Richter et al., 2023).
Risikofaktoren sind:
- Höheres Alter
- Geschlecht männlich
- Rauchen
- Schwangerschaft
- Trisomie 21
- Vorerkrankungen (Herz-Kreislaufsystem, Lungenerkrankungen, Leber- und Nierenerkrankungen, neurologische und psychiatrische Erkrankungen, Diabetes mellitus, Adipositas, Krebs, geschwächtes Immunsystem, D-Dimer-Werte über 3,17 µg/mL (für thrombotische Ereignisse)) (Gabbai-Armelin et al., 2021)
- Chronisch schlechte Schlafqualität wird sogar als kausaler Risikofaktor bei respiratorischen Infektionserkrankungen wie COVID-19 aufgefasst (Jones et al., 2023)
- ein Ungleichgewicht der Pilze im Darm (Prillaman, 2023)
- Über den kausalen Einfluss des Vitamin-D-Spiegels wurde und wird wissenschaftlich wie medial viel diskutiert (Cheung & Cheung, 2021). Durch mehrere systematische Reviews mit Meta-Analysen sowie prospektive Studien ist inzwischen eindeutig belegt, dass eine Vitamin-D-Defizienz mit einem höheren Risiko für eine Infektion mit COVID-19 und einem schweren Verlauf sowie einer höheren Mortalitätsrate einhergeht (Teshome et al., 2021; Barrett et al., 2022; Jordan et al., 2022; Wang et al., 2022). Ein 2023 veröffentlichtes Umbrella Review schlussfolgert:
„Zusammenfassend lässt sich sagen, dass die Ergebnisse der vorliegenden Studie die Empfehlung für eine Vitamin-D3-Supplementierung zur Vorbeugung von COVID-19 unterstützen und bekräftigen (insbesondere bei älteren oder gebrechlichen Menschen, bei Personen, die an das Haus gebunden sind, oder bei Personen, die in Pflegeheimen leben und aufgrund von COVID-19 viel Zeit in geschlossenen Räumen verbringen), wobei gleichzeitig die potenziellen entzündungshemmenden und immunmodulatorischen Eigenschaften von Vitamin D3 hervorgehoben werden, die den Schweregrad und die Sterblichkeit von infizierten Personen verringern. Darüber hinaus sprechen diese Erkenntnisse für die Möglichkeit der Überwachung des Vitamin-D3-Spiegels, insbesondere bei Risikopopulationen“ (Übersetzung des Verfassers) (Petrelli et al., 2023).
- Ein weiteres Umbrella Review von 2023 inklusive Reanalyse der gefundenen Meta-Analysen zeigte, dass neben Vitamin D auch Mikronährstoffdefizienzen an Zink und Kalzium, nicht aber Vitamin C mit einer höheren COVID-19-Mortalität korrelieren (Xie et al., 2023).
Epidemiologie
- Bei COVID-19 handelt es sich um eine Erkrankung, die sich nach erstmaligem Auftreten Ende 2019 pandemisch ausgebreitet hat und von der alle Altersgruppen betroffen sind, wobei Verläufe und Ansteckungsfähigkeit sich nicht nur in den Altersgruppen, sondern auch durch die verschiedenen Varianten erheblich unterscheiden.
- Besondere Bedeutung bei der Verbreitung von COVID-19 (aber auch anderen Atemwegserkrankungen) wird sogenannten Superspreader-Events zugemessen. Eine amerikanische Studie, die im Fachjournal nature veröffentlicht wurde, untersuchte über 700 politische Massenveranstaltungen im Untersuchungszeitraum 2020 bis 2021. Die Autoren konnten entgegen der allgemeinen Annahme keinen statistisch signifikanten Anstieg der Fälle, Todesfälle oder eines Maßes für die epidemische Übertragbarkeit (Rt) in einem Zeitraum von 40 Tagen nach solchen Events feststellen. Dies könne jedoch auch mit der Art und Weise zusammenhängen, wie solche Events durchgeführt wurden (Hygienekonzepte, Aufrufe zu freiweiligen Verhaltensänderungen etc.) (Feltham et al., 2023).
- Anfang 2022 hat sich das Infektionsgeschehen sowohl in Deutschland als auch weltweit erstmals von den Hospitalisierungsraten durch das Auftreten der Omikron-Variante entkoppelt, obwohl es sich bei Omikron um eine Immunflucht-Variante handelt (Madhi et al., 2022; Moore & Baden, 2022; Sievers et al., 2022).
- Die Verbreitung von COVID-19 wird auch im Jahr 2023 von der WHO als globaler Gesundheitsnotstand angesehen (World Health Organization, 2023a). Einige Forscher wie der Stanford-Professor John P. A. Ioannidis sprechen demgegenüber davon, dass nun die endemische Phase aufgrund von rapide fallender Infektionssterblichkeitsraten eingetreten ist. Außerdem solle in der Impfpolitik abgewogen werden, welche Impfschemata notwendig sind und wann es genügend Evidenz gibt, um weitere Auffrischungsimpfungen zu fordern (Pilz & Ioannidis, 2023).
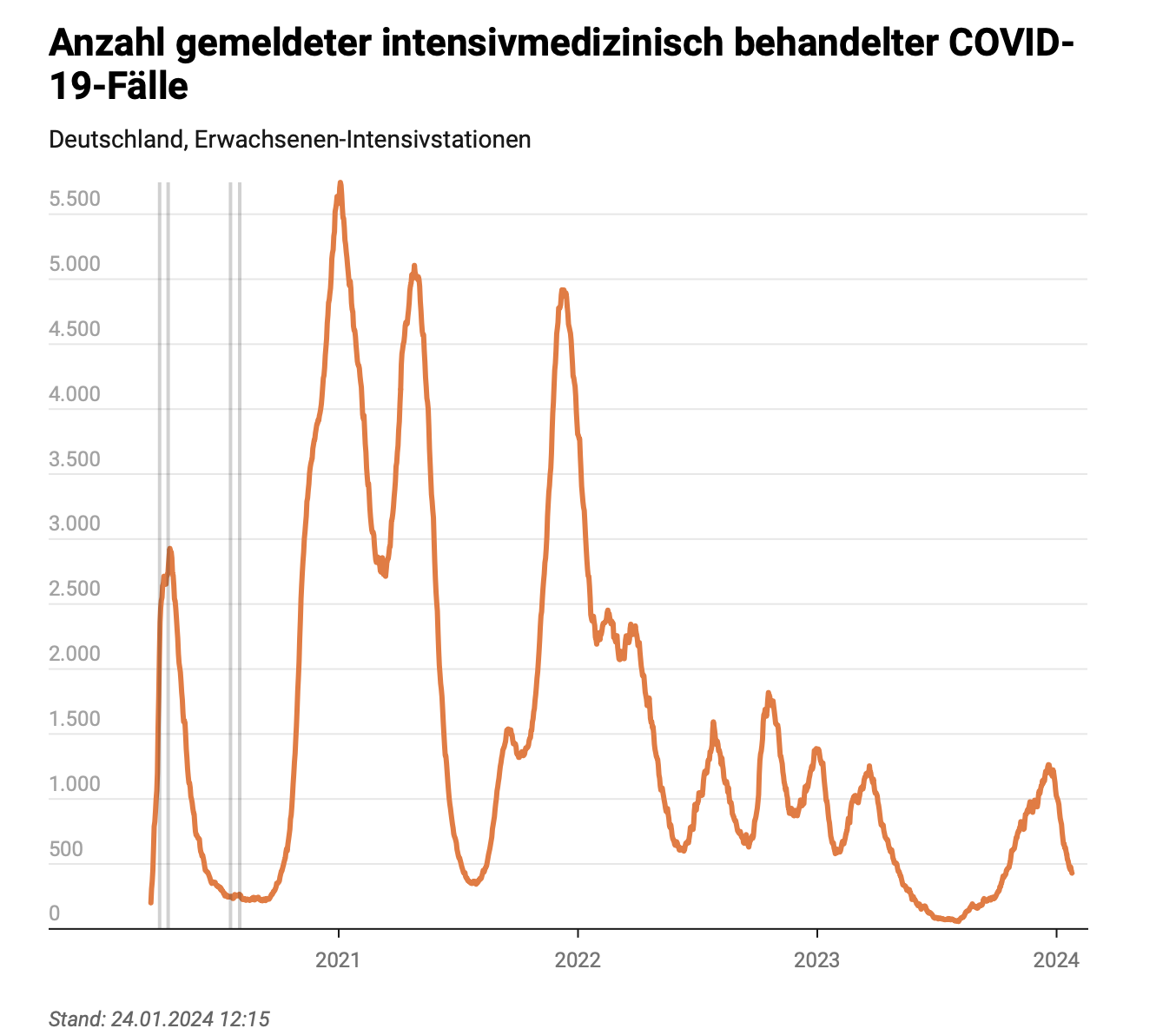
Abbildung 3: Anzahl der vom DIVI zum jeweiligen Beobachtungstag registrierten COVID-19-Patienten (Erwachsene), die intensivmedizinisch behandelt werden müssen im Zeitraum von März 2020 bis Ende Januar 2024 (Deutsche Interdisziplinäre Vereinigung für Intensiv- und Notfallmedizin (DIVI) e.V. & Robert Koch-Institut, 2024). Zur Vergrößerung Bild anklicken.
 Abbildung 4: Neu an das Robert Koch-Institut übermittelte COVID-19-Fälle nach Woche des Erkrankungsbeginns und nach Meldedatum von 8. März 2020 bis 22. Mai 2023 (Robert Koch-Institut, 2023g). Der letzte COVID-19-Wochenbericht des RKI wurde am 8. Juni 2023 veröffentlicht. Zur Vergrößerung Bild anklicken.
Abbildung 4: Neu an das Robert Koch-Institut übermittelte COVID-19-Fälle nach Woche des Erkrankungsbeginns und nach Meldedatum von 8. März 2020 bis 22. Mai 2023 (Robert Koch-Institut, 2023g). Der letzte COVID-19-Wochenbericht des RKI wurde am 8. Juni 2023 veröffentlicht. Zur Vergrößerung Bild anklicken. - COVID-19: Die Impfung
Zulassung
In Deutschland sind Impfstoffe von fünf verschiedenen Herstellern durch das Paul-Ehrlich-Institut nach jeweils verkürzten (teleskopierten) Zulassungsstudien durch die Hersteller, nach Vorlage unvollständiger Daten und vor Abschluss der Phase III zugelassen worden:
- die modifizierten mRNA-Impfstoffe von Biontech/Pfizer Comirnaty® und Moderna Spikevax®
- die Vektorimpfstoffe von AstraZeneca und Johnson&Johnson JCOVDEN®
- der Proteinimpfstoff Nuvaxovid® von Novavax.
- Am 1. September 2022 hat die EU-Kommission zwei an die Omikron-Variante BA.1 angepasste bivalente Impfstoffe von BioNTech und von Moderna zugelassen (Europäische Kommission, 2022).
- Kurze Zeit später, am 12. September 2022, folgte die Empfehlung des Ausschusses für Humanarzneimittel (CHMP) der Europäischen Arzneimittelagentur (EMA) und die Genehmigung der EU-Kommission zur Zulassung des bivalenten BA.4/BA.5-Impfstoffs von BioNTech/Pfizer (Paul-Ehrlich-Institut, 2022).
- Der Mitherausgeber des British Medical Journal (BMJ) Prof. Peter Doshi hat als erster Forscher öffentlich berichtet, dass der BA.4/BA.5 Impfstoff von BioNTech/Pfizer nur an Mäusen getestet wurde und dies für die Zulassung durch die FDA und später die EMA ausreichend war. Die Hersteller geben an, sich auf die klinischen Erfahrungen mit dem angepassten BA.1-Impfstoff zu stützen (Bodderas, 2022).
- Mittlerweile sind an die Omikron Subvariante XBB.1.5 angepasste monovalente Impfstoffe durch die EU Kommission zugelassen worden. Die Zulassung für die BioNTech-/Pfizer-Impfstoffe (Corminaty) mit verschiedenen Wirkstoffmengen (3, 10 und 30 µg) für die unterschiedlichen Altersgruppen wurde am 31. August 2023 erteilt, für den Moderna-Impfstoff (Spikevax) am 15. September 2023 (Paul-Ehrlich-Institut, 2023d, 2023e). Beide Unternehmen teilten bereits vor der Zulassung mit, dass die angepassten Impfstoffe nach präklinischen Daten auch gegen die Varianten EG.5, FL.1.5.1 aber auch BA.2.86 wirksam sein sollen (Dingermann, 2023). Es ist davon auszugehen, dass die Behörden beim Zulassungsprozess keine strengeren Maßstäbe an die neuen Impfstoffe angelegt haben als bei den BA.4/BA.5-Impfstoffen.
Jedoch sind nicht alle Impfstoffe für alle Personengruppen empfohlen (s. STIKO-Empfehlungen).
Effektivität der Impfstrategie
- Studien zeigen, dass die Empfänglichkeit und Infektiosität mit jeder neuen Variante abnehmen, eine Übertragung weder durch die Impfung noch durch eine durchgemachte Infektion verringert werden kann (Frutos et al., 2022; Madewell et al., 2022). Auch für die an die Varianten BA.1 bzw. BA.4/BA.5 angepassten Impfstoffe scheint die Wirkung nicht davon abzuweichen (Callaway, 2022; Kurhade et al., 2023; Meah et al., 2023).
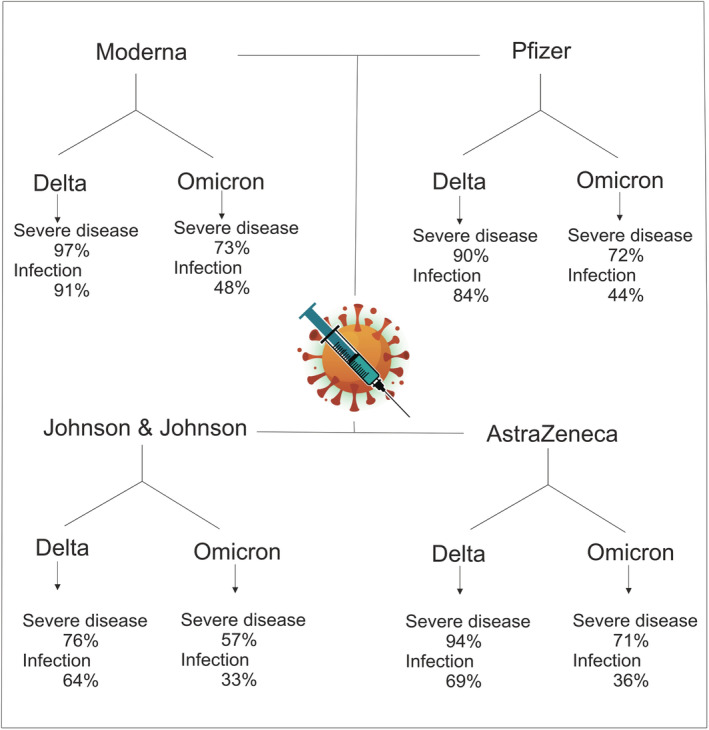
Abbildung 5: Impfinduzierter Schutz unter Omikron und Delta und verschiedenen Impfstoffen (Original und Auflistung aller Impfstoffe von Februar 2022) (Institute for Health Metrics and Evaluation, 2021; Bazargan et al., 2022). Zur Vergrößerung Bild anklicken.
- Klar ist, dass der Impfschutz gegen Infektion und schwere Erkrankung bei Omikron deutlich geringer ist als bei Delta. Der Schutz vor einem schweren Verlauf wird dabei mit 56,5 bis 82,4 % und gegen Infektion mit 23,5 % angegeben. Eine Booster-Impfung kann den Schutz erhöhen, aber nicht auf das gleiche Niveau heben wie bei Delta. Außerdem gibt es Hinweise darauf, dass die an BA.1 bzw. BA.4/BA.5 angepassten Impfungen eine ähnliche Effektivität hinsichtlich der Antikörperausbildung aufweisen wie die monovalenten Impfstoffe (Khoury et al., 2023; Wang et al., 2023a). Demgegenüber schützt eine durchgemachte Infektion auch weiterhin vor neu auftretenden Omikron-Sublinien und wird als mindestens gleichwertig gegenüber der alleinigen Grundimmunisierung angesehen (Malato et al., 2022; Medić et al., 2022; Stein et al., 2023; Lewnard et al., 2023).
- Ein systematisches Review mit Meta-Analyse, das im JAMA-Network veröffentlicht wurde, konnte zeigen, dass 6 Monate nach der Grundimmunisierung der Schutz gegen Infektion und schwere Erkrankung bei unter 20 % lag, mit Booster nach 9 Monaten unter 30 %. Die Immunflucht-Eigenschaften der Omikron-Variante müssten laut den Autoren bei zukünftigen Impfkampagnen demnach stärker berücksichtigt werden (Menegale et al., 2023).
- Komplexer wird es beim Thema der Omikron-Rekombinanten: Einige Studien zeigen, dass der bivalente BA.4/BA.5-Impfstoff gegen BA.2.75.2, BQ.1.1 oder XBB.1 keine robusten neutralisierenden Antikörper-Titer (NAb-Titer) erzeugt. Erst in Verbindung mit einer Infektion würde ein verlässlicher Schutz hergestellt werden, sodass die Autoren folgern, eine Strategie zur Anpassung der Impfstoffe sei unterstützenswert (Kurhade et al., 2023). Eine weitere Studie stellt bezüglich der schwindenden Immunität fest, dass die NAb-Titer gegen XBB.1 und XBB.1.5 nach drei Monaten wieder auf das Ausgangsniveau vor dem Booster zurückgekehrt ist (Lasrado et al., 2023). Auch eine zweite Dosis mit dem bivalenten Impfstoff kann keine ausreichende Antikörperantwort erzeugen (Wang et al., 2023a).
- Eine retrospektive Kohortenstudie mit 51.017 Mitarbeitern der Cleveland Clinic (Ohio, USA) konnte feststellen, dass die bivalenten BA.4/BA.5-Impfstoffe von Pfizer/BioNTech und Moderna nur zu 29 % wirksam bei der Verhinderung von Infektionen waren, wenn die BA.4/5-Linien dominierten, und zu 20 % wirksam, wenn die BQ-Linien dominierten. Es wurde keine Wirksamkeit nachgewiesen, wenn die XBB-Linien vorherrschend waren. Zudem konnte einmal mehr gezeigt werden, dass Personen mit einer höheren Anzahl an verabreichten Impfungen ein höheres Risiko für eine Reinfektion hatten, was sehr wahrscheinlich nicht auf eine statistische Verzerrung zurückzuführen ist. (Shrestha et al., 2023).
- Eine neuere retrospektive Kohortenstudie (September 2023) mit Kalifornischen Gefängnisinsassen ergab bei der Gruppe, die mit dem bivalenten Impfstoff geimpft worden war, gegenüber der ungeimpften Gruppe höhere Omikron-Infektionsraten (3,24 % vs. 2,72 %, Risikodifferenz 0,52 %). Bei den über 50 Jährigen wurde eine Risikodifferenz von 0,92 % gemessen (4,07 % vs. 3,1 %) und bei den über 65 Jährigen sogar 1,95 % (6,45 % vs. 4,5 %). Die Autoren konstatieren dazu: „Frühere Studien zeigten eine hohe Wirksamkeit der COVID-19-Impfstoffe bei der Verringerung der Infektions- und Übertragungsraten, weshalb unsere Ergebnisse verwirrend sind“ (Übersetzung des Verfassers). Die hohe Stichprobengröße sowie die Konsistenz der Kontaktstruktur durch die stark kontrollierte Umgebung im kalifornischen Staatsgefängnissystem dürften jedoch für die Validität des Ergebnisses sprechen und erfordern weitere Untersuchungen (Ko et al., 2023).
- Generell wird die hybride Immunität (Impfung + Infektion) als der verlässlichste Schutz gegenüber schwerer Erkrankung mit SARS-CoV-2-Varianten angesehen (Ntziora et al., 2022; Bobrovitz et al., 2023; Spinardi & Srivastava, 2023). Allerdings stehe laut Forschern die Infektion im Public-Health-Bereich der hybriden Immunität in nichts nach: Sie sei nicht nur robust, sondern es gebe auch bezüglich der hybriden Immunität noch Wissenslücken und Booster sollten nur empfohlen werden, wenn die Evidenz dies hergebe (Pilz et al., 2022; Pilz & Ioannidis, 2023).
- In Bezug auf die Gesamtsterblichkeit (Mortalität) konnten die RCTs mit der längsten möglichen verblindeten Nachbeobachtung keinen statistisch positiven Einfluss durch die mRNA-Impfstoffe im Gegensatz zum Placebo feststellen (Benn et al., 2023). Auch eine Meta-Analyse zu vorhandenen selbstkontrollierten Fallserien mit insgesamt 750.000 eingeschlossenen Patienten findet keinen Einfluss auf die Gesamtsterblichkeit, dafür jedoch einen negativen Einfluss auf die kardial bedingte Sterblichkeit, insbesondere bei Männern.
- Ein Korrelationsanalyse untersuchte die Beziehung zwischen NPIs, Impfungen und Saisonalität (unter Verwendung der durchschnittlichen Inzidenz endemischer humaner Beta-Coronaviren in Schweden über einen Zeitraum von zehn Jahren als Proxy) und dem Fortschreiten der COVID-19-Pandemie anhand von Todesfällen, Krankenhausaufenthalten, der Belegung von Intensivstationen und der Positivitätsrate von Tests in sechs nordeuropäischen Ländern (Bevölkerung 99,12 Millionen) mit Hilfe einer bevölkerungsbasierten, ökologischen Beobachtungsstudie. Es konnte kein Effekt durch die Impfungen oder NPIs festgestellt werden (Quinn, 2024).
- Anders sieht es bei den Adenovirus-Vektor-Impfstoffen aus. Bei diesen konnten zudem sogar unspezifische positive Effekte beobachtet werden wie die Verringerung von Erkrankungen, die nichts mit COVID-19 zu tun haben. Auch für andere Impfstoffe wie den BCG-Impfstoff gegen Tuberkulose sind solche unspezifischen Effekte bekannt. Die genauen immunologischen Mechanismen sind noch unklar, womöglich ist dies auf das Phänomen der trained immunity zurückzuführen, jedoch ist weitere Forschung notwendig, um dies zu untermauern (Benn et al., 2023).
Grundsätzlich kann die Immunogenität durch bestimmte Dispositionen beeinflusst werden:
- Ein 2023 im Journal vaccines veröffentlichtes systematisches Review kommt zu dem Ergebnis, dass die humorale Immunantwort der COVID-19-Impfstoffe mit zunehmendem BMI abnimmt und damit Übergewichtigen aber insbesondere Fettleibigen nur einen gewissen Schutz bieten kann. Auch bei Untergewichtigen könnte das Immunsystem so geschwächt sein, dass eine verminderte Reaktion auf die Impfstoffe möglich wäre. Laut WHO gibt es eine Fettleibigkeitsepidemie – im Fettleibigkeitsbericht 2022 werden 59 % der Menschen in Europa als übergewichtig oder fettleibig aufgeführt (tagesschau.de, 2022). Laut den vaccines-Autoren müssen unbedingt weitere Bemühungen unternommen werden, unerwünschte oder fehlende Wirkungen bei dieser Personengruppe zu untersuchen (Fu et al., 2023).
- Immunschwächere Menschen – wie bei den meisten Impfungen – aber insbesondere auch Transplantatempfänger scheinen laut einem systematischen Review mit Meta-Analyse weniger von den COVID-19-Impfstoffen durch eine geringere Serokonversionsrate zu profitieren (Mehrabi Nejad et al., 2022).
- Dass die Covid-19-Impfstoffe gerade bei Risikogruppen hinsichtlich der Wirksamkeit schlechter bewertet werden, ist in Anbetracht dessen, dass gerade diese Personengruppen Schutz vor einer Covid-19-Erkrankung benötigen, problematisch. Dies bestätigt einmal mehr eine im Juni 2023 veröffentlichte Meta-Analyse zu 33 Beobachtungsstudien: „Die Werte für IgG, IgA, IgM, neutralisierende Antikörper und T-Zellen waren in gefährdeten Bevölkerungsgruppen deutlich niedriger als in gesunden. Die positiven Nachweisraten von IgG- und IgA-Antikörpern sowie die zellulären Immunreaktionsraten waren in den gefährdeten Bevölkerungsgruppen ebenfalls geringer“ (Übersetzung des Verfassers) (Li et al., 2023).
Antigenerbsünde & Immuntoleranz:
Es gibt verschiedene Phänomene, die die Immunogenität bei den vorhandenen SARS-CoV-2-Impfstoffen beeinflussen und verschiedene Theorien darüber, warum dies so ist:
- Als Antigenerbsünde wird die Theorie bezeichnet, nach der der Körper schlechter Antikörper gegen Virusvarianten ausbilden kann, wenn bereits Kontakt zu vorherigen Virusvarianten – etwa durch Infektion oder Impfung – bestand. Schon vor der COVID-19-Pandemie wurde bei Viren wie Influenza über die Theorie diskutiert. Bei den angepassten bivalenten SARS-CoV-2-Impfstoffen konnten bereits geringere Antikörperreaktionen im Vergleich zu den monovalenten Impfstoffen mit der Ursprungsvariante gemessen werden, insbesondere bei den neueren Varianten, was weitere Hinweise auf die Antigenerbsünde liefert. Für den Immunologen Andreas Radbruch bleibt die Frage, „wie stark der Effekt ist, und ob er durch eine starke Prägung auf das Originalantigen gehemmt wird. […] Zusammengefasst: Präexistierende und direkt nach dem Boost gebildete Antikörper, die den Impfstoff erkennen, maskieren das Antigen, schützen vor schwerer Krankheit, aber sie hemmen auch eine weitere Immunreaktion. Ein Argument gegen wiederholtes „blindes“ Boostern“ (Deutsches Ärzteblatt, 2023).
- Forscher einer 2023 im Journal vaccines veröffentlichten Studie vermuten eine über hohe Werte an IgG4-Antikörper entstehende Immuntoleranz. Bisher wurde angenommen, dass IgG4-Antikörper eine schützende Wirkung haben, indem sie eine Überreaktion des Immunsystems eindämmen. Laut den Forschern gibt es jedoch neuere Erkenntnisse, nach denen hohe IgG4-Antikörper, auftretend nach mehrmaliger Impfung, einen Mechanismus der Immuntoleranz gegenüber dem Spike-Protein darstellt. Übermäßiges Impfen sei demnach „in dichten Populationen mit Vorsicht zu genießen“ (Übersetzung des Verfassers). Erhöhte IgG4-Werte könnten zudem die Entstehung von Autoimmunerkrankungen, autoimmune Myokarditis und Krebs begünstigen. Auch bei den Keuchhusten- und Malaria-Impfstoffen wird über eine hohe IgG4-Synthese berichtet (Uversky et al., 2023).
Weitere Informationen zur Effektivität der Impfstrategie können Sie unserer Stellungnahme an den Gesundheitsausschuss des Deutschen Bundestages von Oktober 2022 entnehmen.
Impfnebenwirkungen
Impfreaktionen
- Die Prävalenz von Impfreaktionen wie Rötungen, Schwellungen oder Schmerzen an der Einstichstelle wurde in einer systematischen Übersichtsarbeit mit 72,16 % angegeben (Washrawirul et al., 2022).
- In einer Studie an Fachkräften im deutschen Gesundheitswesen wurde eine Häufigkeit von 88,1 % von mindestens einer Impfreaktion festgestellt (Klugar et al., 2021).
- Im Vergleich zwischen dem BioNTech/Pfizer- und dem Moderna-Impfstoff wurde in einer Online-Querschnittsbefragung eine Prävalenz von 60 bzw. 41 % Impfreaktionen nach der ersten Impfung und 92 bzw. 70 % nach der zweiten Impfung festgestellt, wenn mindestens ein Symptom vorhanden war. Besonders häufig waren Impfreaktionen bei Teilnehmern, die schon einmal wegen COVID-19 ins Krankenhaus eingeliefert wurden (96 %) oder einen leichten oder mittelschweren Verlauf hatten (86 %) (Parés-Badell et al., 2021). Die Hersteller der Impfstoffe machen in den Fachinformationen ähnliche Angaben (Paul-Ehrlich-Institut, 2023c).
Impfkomplikationen
Impfkomplikationen der COVID-19-Impfungen umfassen u. a.:
- Erkrankungen des Herz-Kreislaufsystems, vor allem Myokarditis und Perikarditis (Mansanguan et al., 2022).
- Verlust des Gehörs, Tinnitus, Schwindelgefühl, Thrombosen, Thrombozytopenie (World Health Organization, 2022a).
- Kribbeln der Haut (Parästhesie), vermindertes Gefühl (der Haut) (Hypoästhesie), starke Schwellung der Gliedmaße, in die geimpft wurde, Guillain-Barré-Syndrom (GBS), Anaphylaxie (World Health Organization, 2022b).
Es werden zudem immer wieder neue Studien veröffentlicht, die über weitere Impfkomplikationen bei Patienten berichten:
- Eine retrospektive Studie zu klinischen Merkmalen von Patienten nach COVID-19-Impfung mit verschiedenen persistierenden Symptomen zeigte neben den häufigsten Symptomen, wie Empfindungsstörungen, Müdigkeit, Fieber und Kopfschmerzen auch schwerere Symptome: Etwa myalgische Enzephalomyelitis/chronisches Müdigkeitssyndrom (ME/CFS), Sarkoidose, aseptische Meningitis, Neuromyelitis-optica-Spektrum-Störungen (NMOSDs), Sehnenverklebungen und idiopathische Thrombozytopenie. Alle Symptome traten zwischen 12 Stunden und einer Woche nach der Impfung auf, wobei 10 Symptome 6 Monate oder länger anhielten (Tokumasu et al. 2023).
- Inzwischen werden zunehmend auch Menstruationsanomalien als Folge der COVID-19-Impfungen untersucht. Eine niederländische Studie mit Daten des nationalen Spontanmeldesystems konnte einen Zusammenhang für die Altersgruppe 25-34 Jahre und den Pfizer/BioNTech-Impfstoff herstellen. Zusätzlich wurden auch Daten einer prospektiven Kohorten-Ereignisüberwachungsstudie (CEM) genutzt. Diese ergab eine Inzidenz von 41,4 pro 1.000 Frauen im Alter von ≤54 Jahren. Die Autoren folgern, dass die Impfnebenwirkung weiter untersucht werden sollte (Duijster et al., 2023). In einem systematischen Review reichte die Gesamtrate an Menstruationsanomalien von 0,83 bis 90,9 %. Als Risikofaktoren wurden Alter, vergangene Schwangerschaft, systemische Nebenwirkungen von COVID-19, Rauchen und die zweite Dosis des COVID-19-Impfstoffs identifiziert (Nazir et al., 2022).
- Weiterhin wird auch über das Risiko von retinalen Gefäßverschlüssen (RVOs) nach mRNA-Impfung diskutiert. Zwei Studien, eine groß angelegte, multizentrische Untersuchung sowie ein Review liefern Hinweise für eine erhöhtes Vorkommen von RVOs bei geimpften im Vergleich zu ungeimpften Probanden. Das Risiko sei hierbei bis zu zwei Jahre nach Impfung erhöht. Eine Kausalität wurde bisher noch nicht entdeckt, beide Autorengruppen folgern jedoch, dass weitere Studien dringend notwendig sind. Denn retinale Gefäßverschlüsse stehen in Zusammenhang mit Thromboembolien.
- Bisher weniger diskutiert wurde über mögliche Veränderungen des Blutdrucks durch mRNA-Impfstoffe. Eine Meta-Analyse mit umfangreichen Daten aus einer Pharmakovigilanz-Datenbank zeigen eine relativ hohe Inzidenz von anhaltendem Blutdruck: Bei bis zu 17 % der Befragten, vornehmlich jungen Erwachsenen, sei dieses Phänomen über eine mittlere Nachbeobachtungszeit von 4 Monaten festzustellen. Ältere Befragte (über 65 Jahre) seien weniger davon betroffen. Die Autoren konstatieren, dass es unwahrscheinlich sei, dass es sich um einen psychologischen Effekt handele, und vielmehr auf die Covid-19-Impfung zurückzuführen sei. Deshalb sei eine langfristige und systematische Überwachung der kardiovaskulären Auswirkungen nach Covid-19-Impfstoffen unbedingt erforderlich (Patamatamkul & Potongcamphan, 2023).
Letztlich werden auch seltenere Komplikationen in Einzelfallstudien berichtet. Inwiefern Zusammenhänge zwischen einzelnen Symptomen bestehen, ist nicht abschließend geklärt.
- Im Sicherheitsbericht des Paul-Ehrlich-Instituts (bis zum 31. Oktober 2022) werden insgesamt 331.900 Verdachtsfälle von Impfnebenwirkungen bei ca. 188 Millionen verabreichten Impfungen aufgelistet, davon 50.145 schwerwiegende. Die Melderate von Verdachtsfällen schwerwiegender Impfnebenwirkungen pro 1.000 Impfungen liegt somit bei 0,29, gerundet ca. 3 pro 10.000 Impfungen (Paul-Ehrlich-Institut, 2023b). Inzwischen (30. März 2023) wurden 192,2 Millionen Impfdosen verabreicht (Bundesministerium für Gesundheit, 2023).
- Aufgrund der passiven Erhebung von Impfnebenwirkungen durch das Paul-Ehrlich-Institut in Deutschland ist von einer Untererfassung auszugehen. Ein amerikanisches systematisches Review schätzt die Untererfassung von unerwünschten Arzneimittelwirkungen (UAW) auf 94 %, die Untererfassung schwerer UAWs wurde auf 85 % geschätzt (Hazell & Shakir, 2006).
- Laut einer Harvard-Studie aus dem Jahr 2010 zum passiven Spontanmeldesystem VAERS der USA, das ähnlich wie in Deutschland funktioniert, werden nur etwa 0,3 % aller Impfnebenwirkungen und 1-13 % der schwerwiegenden gemeldet (U.S. Department of Health & Human Services, 2023). Das passt zu den Erfahrungen des Berliner Hausarztes Dr. Erich Freisleben, der berichtet, dass bei 300 Patienten, die sich bei ihm wegen Corona-Impfkomplikationen gemeldet haben, nur 3 dieser Fälle an das PEI gemeldet wurden (Bodderas et al., 2022).
Myokarditis & Perikarditis
Häufiger Bestandteil von Diskussionen ist der Vergleich der Prävalenz von Myokarditiden bzw. Perikarditiden nach Infektion und nach Impfung.
- Eine Kohortenstudie mit 23 Millionen Einwohnern der nordischen Länder (Dänemark, Finnland, Norwegen, Schweden) fand ein erhöhtes Risiko nach erster und zweiter mRNA-Impfung, vor allem für junge Männer. Die Prävalenz wird mit 4 bis 7 zusätzlichen Ereignissen in 28 Tagen pro 100.000 Geimpfte nach Comirnaty® und 9 bis 28 zusätzlichen Ereignissen pro 100 000 Geimpfte nach Spikevax® angegeben (Karlstad et al., 2022).
- Eine 2023 veröffentlichte Meta-Analyse kommt zu dem Schluss, dass die Inzidenz von Myokarditis und Perikarditis nach Impfung höher ist als nach Infektion, die Gesundheitsrisiken von COVID-19 würden jedoch die Risiken durch die Impfung überwiegen (Gao et al., 2023).
- Es gibt jedoch auch ein systematisches Review mit Meta-Analyse, das aufgrund der Einschlusskriterien zu einem anderen Ergebnis kommen: dass ein siebenfach höheres Risiko besteht, eine Myokarditis nach einer Infektion zu bekommen (Voleti et al., 2022).
- Ebenso wurde in einer Kohortenstudie der erwähnten nordischen Länder berichtet, dass Myokarditiden nach Impfung innerhalb von 90 Tagen nach der Krankenhauseinweisung „milder“ verlaufen sollen als nach SARS-CoV-2-Infektion (Husby et al., 2023).
- Eine Follow-up-Studie aus Deutschland und Kanada mit relativ kleiner Stichprobe kann dieser Beobachtung jedoch nicht beipflichten. 12 (24 %, davon 75 % weiblich) der 50 Patienten mit anfänglich milder Impfmyokarditisdiagnose (geringe kardiale Beteiligung, wenige EKG-Veränderungen, niedriges CRP) hatten gemittelt etwa 228 Tage lang persistierende Beschwerden – darunter Brustschmerzen (8/12, 67 %), Dyspnoe (7/12, 58 %), mit zunehmendem Auftreten von Müdigkeit (5/12, 42 %) und Herzklopfen. Die Autoren folgern, dass Impfmyokarditen zwar häufiger bei jungen Männern vorkommen würden, Frauen jedoch häufiger über persistierende Symptome berichten würden (Schroth et al., 2023).
- Demgegenüber steht eine retrospektive Studie der südkoreanischen Behörde für Seuchenkontrolle und -prävention (KDCA), die mit 0,1 / 100.000 Einwohner eine niedrigere Inzidenz an impfbedingter Myokarditis in der Gesamtbevölkerung im Vergleich zu anderen Studien findet, aber bei etwa 19,8 % der Fälle schwere Verläufe feststellt. Ein schwerer Verlauf wurde dabei als Aufnahme auf die Intensivstation, eine fulminante Myokarditis (FM), Einsatz extrakorporaler Membranoxygenierung (ECMO), die Notwendigkeit einer Herztransplantation oder Tod definiert (Cho et al., 2023).
- Die HART-Gruppe (Health Advisory & Recovery Team) schätzt es aufgrund der Erfassung von Impfnebenwirkungen als extrem wahrscheinlich ein, dass die Inzidenz von Myokarditiden nach Impfung unterschätzt wird (Health Advisory & Recovery Team, 2022).
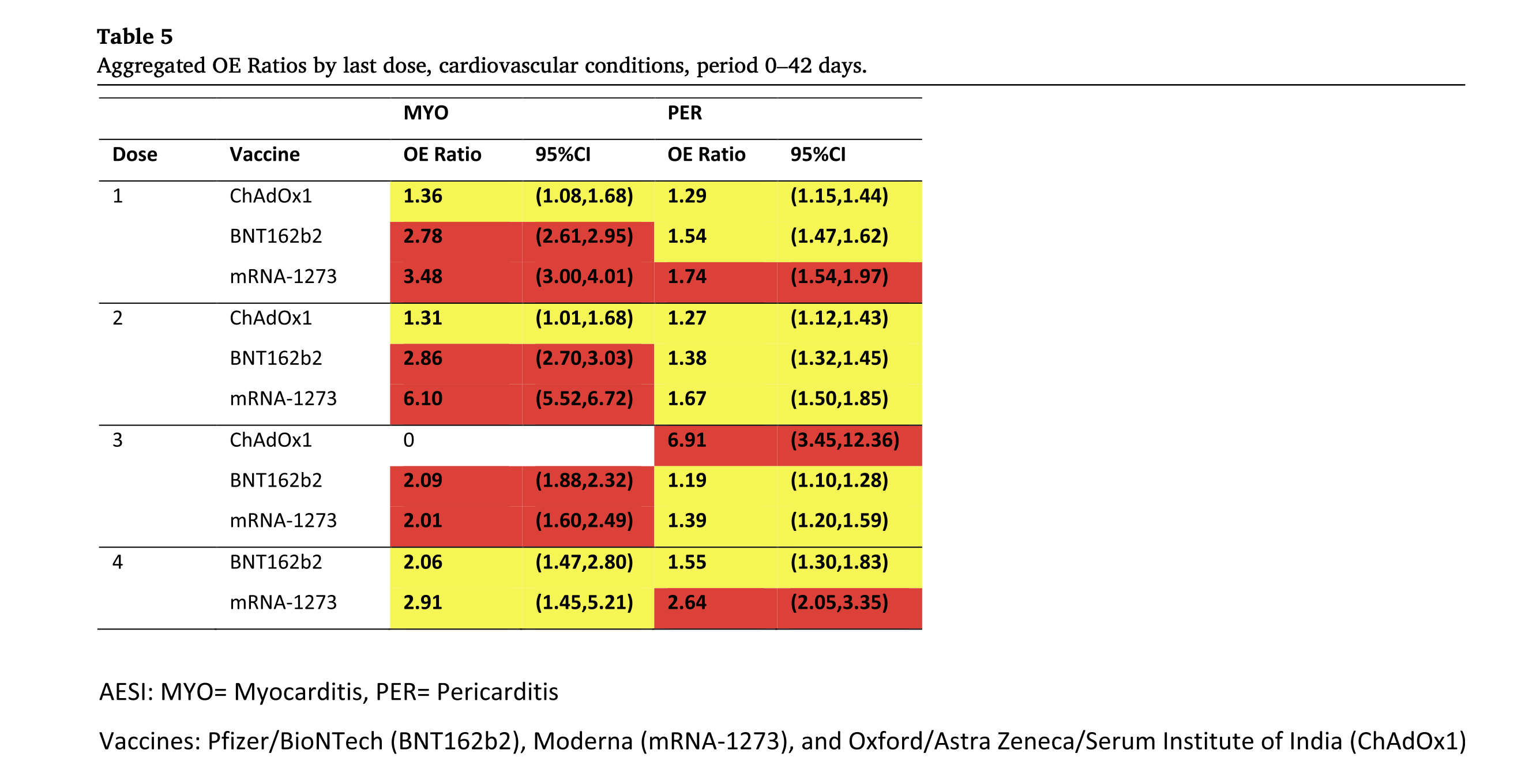
- Eine 2024 im Fachjournal Vaccine erschiene Beobachtungsstudie, mit Daten von über 99 Millionen geimpften Personen aus 8 verschiedenen Ländern die wohl bisher größte Kohortenstudie, kommt zu dem Ergebnis, dass nach allen verabreichten Impfstoffdosen bei BNT162b2 und mRNA-1273 ein Sicherheitssignal für Myokarditis besteht und bei mRNA-1273 nach der 1. und 3. Impfstoffdosis auch für Perikarditis. Für weitere Informationen zu dieser Studie lesen Sie bitte hier weiter.
Abbildung 6: In Tabelle 5 aus der Studie von Faksova et al. (2024) sind BNT162b2/Corminaty, mRNA-1273/Spikevax und ChAdOx1/Vaxzevria nach der Anzahl der verabreichten Impfdosen eingeteilt und in ihrer Häufigkeit für kardiovaskuläre Erkrankungen (Myokarditis, Perikarditis) nach einem Ampel-Schema (Rot, Gelb, Grün) dargestellt. Schwellenwerte für statistische Hinweise auf mögliche Signale – Rot: LBCI* >1,5, statistisch signifikantes Sicherheitssignal; Gelb: LBCI* >1 und <1,5, statistisch signifikant; Grün: LBCI* <1,0, nicht statistisch signifikant; *LBCI: Untere Grenze des Konfidenzintervalls (Faksova et al., 2024).
- Letztlich konnte eine 2024 in npj vaccines (nature) erschiene Fall-Kontroll-Studie zeigen, dass ein etwa 66 % geringeres Karditis-Risiko für männliche Jugendliche bestand, wenn das Intervall zwischen der ersten und zweiten BNT162b2 von 21 bis 27 Tagen auf ≥ 56 erhöht wurde (Fan et al., 2024).
Post-Vac-Syndrom
Die Abgrenzung vom Post-Vac-Syndrom zu Impfnebenwirkungen gestaltet sich neben der uneinheitlichen Definition schon aufgrund des verwendeten Terminus als schwierig, da im Grunde genommen alle Nebenwirkungen „Post-Vac“ sind. Meist werden hierbei aber Symptome gemeint, die denen von Long- bzw. Post-Covid ähneln. Zudem werden immer wieder auch
- ME/CFS (Myalgische Enzephalomyelitis/Chronisches Fatigue-Syndrom),
- Multisystemisches Entzündungssyndrom (Mis-C bzw. PIMS) und
- Posturales Tachykardiesyndrom (POTS)
als Folgen einer COVID-19-Impfung genannt (Gießelmann & Martin, 2022).
- Bisher gibt es nur zwei Spezialambulanzen in Deutschland, die Long- bzw. Post-COVID und das Post-Vac-Syndrom behandeln: Die Marburger-Spezialambulanz des Universitätsklinikums und die neurologische Post-COVID-19-Sprechstunde an der Klinik für Neurologie, Charité Universitätsmedizin Berlin.
- Die genauen Mechanismen sind, ähnlich wie bei Long- bzw. Post-COVID, noch unbekannt. Es gibt jedoch Anhaltspunkte, nach denen die über die Impfung erzeugten Spike-Proteine Einfluss auf bestimmte Gefäßrezeptoren (z. B. antiidiotopische Antikörper) ausüben und so systematische Nebenwirkungen verursachen oder über die Induktion einer ganzen Reihe von Autoantikörpern Immunprozesse anstoßen, die im gesamten Körper zu unerwünschten Wirkungen führen können (Murphy & Longo, 2022).
- Erste Forschungsarbeiten lassen darauf hoffen, dass es bestimmte Blutparameter gibt, die Ärztinnen und Ärzten zukünftig dabei helfen können, das Post-Vac-Syndrom frühzeitig zu erkennen. In einer Untersuchung von Forschern der Universität Düsseldorf (Preprint) konnten im Vergleich zur „normalen“ serologischen Impfreaktion signifikant erhöhte Angiotensin-II-Typ-1-Rezeptor-Antikörper, verringerte alpha-2B-Adrenorezeptor-Antikörper und erhöhtes Interleukin-6 gemessen werden (Semmler et al., 2023).
- Eine anhand von Online-Selbstberichten durchgeführte Studie konnte bei geimpften und teil-geimpften Befragten, insbesondere Befragten, die nur mit mRNA-Impfstoffen geimpft wurden, eine stärkere Verringerung der physischen Aktivität im Vergleich zu ungeimpften Befragten nach einer SARS-CoV-2-Infektion herausfinden. Die verringerte physische Aktivität wird als ein wichtiges Symptom bei einer Long-COVID- bzw. Post-Vac-Syndrom-Diagnose erachtet (Bourdas et al., 2023).
Unsere Leitfäden (unter Federführung von Dr. med. Freisleben und Dr. med. Brüggemann zu Long- bzw. Post-Covid sowie zum Post-Vac-Syndrom finden Sie hier.
Impfschäden
- Bis Februar 2023 wurden laut Welt am Sonntag deutschlandweit rund 6.000 Anträge auf Hilfe in Folge schwerer gesundheitlicher Folgen durch eine Corona-Impfung gestellt, jedoch wurden bisher nur 253 Impfschäden anerkannt. 1808 Anträge wurden abgelehnt und 3968 weitere sind noch in Bearbeitung. Überwiegend handelt es sich dabei um Fälle von Myokarditis, Sinusvenenthrombosen und das Guillain-Barré-Syndrom, vereinzelt aber auch um Todesfälle (FOCUS online, 2023).
- Bis 15. Juni 2023 hat sich die Anzahl der Anträge auf Impschäden auf knapp 9.000 summiert. Dies geht aus einer ZEIT ONLINE Abfrage bei den Behörden aller Bundesländer hervor. So ergibt sich ein Verhältnis von 1 Antrag pro 10.000 Impfung. Bisher sind etwa 40 % der Anträge (3.488) bearbeitet und etwa 397 Fälle anerkannt worden. Die Anerkennungsquote liegt damit bei 11 % (Schumann & Erdmann, 2023).
- In einem am 12. Juni 2023 veröffentlichten Artikel in ZEIT ONLINE erklären Thomas Kerner (Jurist) und Bernhard Kleiser (Mediziner), beide im Verwaltungsverfahren zur Anerkennung eines Impfschadens des Zentrums Bayern Familie und Soziales (ZFBS) tätig, wann Anträge auf einen Corona-Impfschaden anerkannt und wann abgelehnt werden.
Laut Kerner müssen drei Tatbestände erfüllt sein: Die öffentliche Empfehlung der Impfung, eine diagnostizierte gesundheitliche Schädigung und ein kausaler Zusammenhang – ein zeitlicher Zusammenhang reiche nicht aus, müsse aber gegeben sein. Zusätzlich sei die Krankengeschichte notwendig, die in Form von medizinischen Befunden, Krankenkassenauszügen und eventuell externen Gutachtern nachvollzogen wird. Außerdem müsse laut Kleiser aus der Literatur eine Häufung der gesundheitlichen Schädigung nach der Impfung hervorgehen. Da beispielsweise Herzinfarkte in der Bevölkerung sehr häufig vorkommen, sei die Wahrscheinlichkeit eines kausalen Zusammenhangs hier sehr gering.
Für Post-Vac gebe es wiederum noch keine internationale Diagnose – erst, wenn weitere Forschung die notwendige Sicherheit bringen würde, dass das heterogene Post-Vac-Syndrom durch die Corona-Impfung verursacht werde, wären solche Impfschadensfälle anzuerkennen. Sollte sich die wissenschaftliche Literatur ändern, könnten Betroffene einen Neufeststellungsantrag stellen und bis zu vier Jahre rückwirkend Leistungen erhalten.
Zuletzt ergänzt Kleiser, dass vor der Pandemie etwa 40 Anträge auf Impfschäden jährlich in Bayern eingingen – inzwischen seien es insgesamt über 2.000, davon alleine 2022 über 1.200. Es gebe auch mehr Anträge auf Impfschäden bei anderen Impfungen wie den Mehrfachimpfungen bei Kindern aber auch Grippeimpfungen, was der Jurist auf die öffentliche Aufmerksamkeit des Themas zurückführt (Schumann & Wüstenhagen, 2023).
Adjuvantien
- Lipidnanopartikel (LNP) werden in den COVID-19-Impfstoffen als neuartige Träger der mRNA-Moleküle genutzt. Laut American Chemical Society (ACS) wären die mRNA-Impfstoffe ohne LNPs nicht umsetzbar gewesen, denn die mRNA-Moleküle können nicht von alleine in die Zellen gelangen (Cross, 2021).
- Es gab bereits virosomale Impfstoffe wie Epaxal gegen Hepatitis A oder Inflexal gegen Influenza mit strukturell ähnlichen Trägerstoffen, den Liposomen. Diese sind jedoch nicht mehr auf dem Markt verfügbar – laut Paul-Ehrlich-Institut nicht aufgrund von Sicherheitsbedenken. Strukturell sind LNPs als Phospholipide mit darin eingelagertem Cholesterin aufgebaut. Außerdem gibt es weitere Lipidbestandteile, die spezifische Anforderungen erfüllen. LNPs gelten laut PEI als „biologisch abbaubar“ (Paul-Ehrlich-Institut, 2023a).
- Lipidnanopartikel wirken in Mäusestudien stark entzündlich:
„Die intradermale und intramuskuläre Injektion dieser LNPs führte zu schnellen und robusten Entzündungsreaktionen, die durch massive Neutrophileninfiltration, Aktivierung verschiedener Entzündungswege und Produktion verschiedener entzündlicher Zytokine und Chemokine gekennzeichnet waren. Die gleiche Dosis LNP, die intranasal verabreicht wurde, führte zu ähnlichen Entzündungsreaktionen in der Lunge und hatte eine hohe Sterblichkeitsrate zur Folge, wobei der Mechanismus noch nicht geklärt ist“ (Übersetzung des Verfassers).
Dies lässt die Autoren folgern, dass LNPs zur Entwicklung von Nebenwirkungen durch die COVID-19-Impfstoffe beitragen könnten (Ndeupen et al., 2021). - Aufgrund der Beobachtung, dass Myokarditiden nach mRNA-Impfstoffen häufiger vorkommen als nach anderen COVID-19-Impfstoffen, wurde postuliert, dass Lipidnanopartikel bei der Pathogenese eine Rolle spielen könnten (Tsilingiris et al., 2022).
- Auf Nachfrage der Chemie-Professoren um Jörg Matysik wurde klar, dass das Paul-Ehrlich-Institut stichprobenmäßig keine Polydispersitätstests durchführt. Diese sind wichtig, um die Größenverteilung und Zusammensetzung der LNPs in den COVID-19-Impfstoffdosen zu messen. Die Professoren schreiben dazu in der Berliner Zeitung:
„Wenn nun über die Kontrollmethode zur Verteilung der mRNA zwischen LNPs und Dispersionsmedium in Mehrdosenbehältnissen beim PEI keine gesicherten Informationen vorliegen, dann folgern wir daraus, dass vom PEI nicht überprüft wird, ob sich die mRNA überhaupt vollständig in den LNPs befindet oder direkt im Dispersionsmedium gelöst ist. Dabei sollte auch dem PEI bekannt sein, dass freie mRNA in der Blutbahn zu Thrombosen führen kann. Wenn also eine effiziente Verpackung der mRNA in den LNPs nicht durch das PEI überprüft wird, wie kann man dann von einer Überwachung der Sicherheit der sogenannten Impfstoffe bei der Chargen-Freigabe durch das PEI sprechen?“ (Matysik, 2023).
Weiterführendes
- Lange Zeit wurde in der Fachwelt angenommen, dass mRNA-Impfstoffe an der intramuskulären Verabreichungsstelle schnell abgebaut und nicht weiter im Körper verteilt werden (Biodistribution). Erste Zweifel daran warfen Tierstudien auf. Im September 2022 folgte dann eine JAMA-Studie mit 11 stillenden Müttern, in deren Muttermilch erstmals mRNA nachgewiesen werden konnte. Am Ende blieb die Frage für die Autoren offen, warum andere Studien zu einem gegensätzlichen Ergebnis gekommen waren: „Wie ist es möglich, dass Impf-mRNA jetzt in Muttermilch nachgewiesen werden konnte, im Juli 2021 jedoch noch nicht?“ (Übersetzung des Verfassers) (Hanna et al., 2022). Eine im Oktober 2023 im renommierten Fachmagazin The Lancet veröffentlichte Studie mit 13 gesunden und stillenden Müttern nach der Geburt scheint die Biodistribution von mRNA endgültig zu beweisen. Mittels quantitativer digitaler Tröpfchen-PCR wurden bis zu 45 Stunden nach einer Impfung in der Hälfte der Fälle (10 von 20 verabreichten Impfungen) Spuren von mRNA in Brustmilch nachgewiesen. Die Autoren der Studie raten stillenden Müttern dazu, einen Dialog mit entsprechenden Gesundheitsdienstleistern aufzunehmen, da die minimale mRNA-Dosis, die eine Immunreaktion bei Säuglingen <6 Monaten auslösen kann, nicht bekannt ist (Hanna et al., 2023). Faktenchecker, Behörden und Experten müssen somit ihre Meinung revidieren (MDR, 2021; zdfheute, 2021; FOCUS online, 2022). Weiterhin zu klären bleibt jedoch der Grad der Translationsaktivität der mRNA in der Muttermilch.
- Die Impfstoff-mRNA konnte bei Patienten, die bis zu 30 Tage nach Impfung verstarben im Gewebe, vor allem im Herzmuskel und den axillären Lymphknoten, nachgewiesen werden (Krauson, 2023).
- In einer Studie von Arbel et al. (2021) stellten die Autoren eine 90 % niedrigere Sterblichkeit nach Erhalt einer COVID-19-Booster-Impfung fest. In einer im Juli 2023 im New England Journal of Medicine veröffentlichten Korrespondenz weisen Høeg, Duriseti und Prasad darauf hin, dass es bei der Verteilung der Probanden einen Healthy Vaccinee Bias (wörtl. Gesunde Impflinge Risiko) gegeben haben könnte bzw. dieser nicht vollständig ausgeschlossen werden könnte. Das bedeutet, dass der Effekt durch die Booster-Impfung dadurch überschätzt worden sein könnte, dass in der Booster Gruppe im Vergleich zur Kontroll-Gruppe weniger Menschen mit Vorerkrankungen vertreten waren (Høeg et al., 2023).
- Sowohl eine vollständige Impfserie als auch eine Infektion sind über SARS-CoV-2-spezifische IgA- und IgG-Antikörper in Tränen nachweisbar, was auf die Wichtigkeit der Augenoberfläche als erste Verteidigungslinie hinweist. Es scheint jedoch keinen Unterschied zwischen zweifacher und dreifacher Impfung zu geben (Guemes-Villahoz et al., 2023).
- Während der COVID-19-Pandemie stellten Forscher die Hypothese auf, dass der gegen Tuberkulose eingesetzte Bacille-Calmette-Guérin (BCG)-Impfstoff vor einer COVID-19-Infektion oder einem schweren Verlauf schützen könnte. Ein 2023 veröffentlichtes RCT konnte jedoch keinen Unterschied gegenüber einem Placebo zeigen (Pittet et al., 2023).
- Der Preisanstieg des bivalenten COVID-19-Impfstoffes auf 120 US-Dollar veranlasste israelische Forscher zu einer Berechnung der ökonomischen Kosten zur Verhinderung eines schweren COVID-19-Verlauf bzw. Todesfalles. In der Altersgruppe 18-64 wurde die Anzahl der Impfungen zur Verhinderung eines schweren Verlaufs auf 20.407 geschätzt. Zur Verhinderung eines Todesfalls lag die Schätzung bei 100.304 Impfungen. Dies entspricht 2,45 Mio. Dollar pro verhindertem schweren Verlauf bzw. 12,04 Mio. Dollar pro verhindertem Todesfall. Dies sei unhaltbar und veranlasste die Forscher, die Richtlinie des CDC zu hinterfragen, nach der alle Personen ab 6 Monaten eine bivalente Auffrischungsimpfung erhalten sollen (Arbel et al., 2023).
- COVID-19: Die STIKO-Empfehlungen
Die Empfehlungen
Die STIKO nimmt immer wieder Änderungen an ihren COVID-19-Impfempfehlungen vor. Diese Aktualisierungen (Robert Koch-Institut, 2024) entsprechen mittlerweile einigen Forderungen von ÄFI im offenen Brief an die STIKO:
- Für Kinder und Jugendliche unter 18 Jahren gibt es keine allgemeine Impfempfehlung mehr.
- Anders als von ÄFI gefordert wird Erwachsenen zwischen 18 und 59 Jahren eine Basisimmunität, bestehend aus mindestens einer Impfung sowie zwei weiteren Antigenkontakten (Impfung oder Infektion) empfohlen.
- Ab einem Alter von 60 Jahren wird eine jährliche Auffrischimpfung empfohlen – die Vektorimpfstoffe sind jedoch nicht mehr empfohlen (Robert Koch-Institut, 2023d).
Am 18. September 2023 hat die STIKO zudem die XBB.1-COVID-19-Impfstoffe in den Katalog ihrer Impf-Empfehlungen aufgenommen. Die angepassten Impfstoffe sind nicht nur als Auffrischimpfungen zugelassen, sondern auch als Grundimmunisierung (Robert Koch-Institut, 2023f).
- Mittlerweile ist für die Grundimmunisierung, die aus insgesamt 3 Antigenkontakten bestehen soll, eine Impfung ausreichend, wenn zwei Infektionen nachgewiesen werden können (Robert Koch-Institut, 2024).
Weiterhin gilt:
- Kinder ab 6 Monaten sollen nur bei Vorerkrankung und unabhängig von durchgemachten Infektionen geimpft werden. Vorzugsweise soll Comirnaty® mit drei Impfstoffdosen genutzt werden (Robert Koch-Institut, 2023c).
- Schwangere sollen sich nach STIKO-Empfehlung ausschließlich mit dem Impfstoff von BioNTech/Pfizer ab dem zweiten Trimenon impfen lassen.
- Der Proteinimpfstoff von Novavax (Nuvaxovid®) wird von der STIKO für alle Personen ab 12 Jahren zur Grundimmunisierung empfohlen und wird mittlerweile nicht mehr auf unter 30-Jährige beschränkt.
- Die STIKO empfiehlt seit August 2022 eine 4. Impfung für alle Personen ab 60 Jahre (Robert Koch-Institut, 2023a).
Aktuelle Impftabelle:
Indikationsgruppe
Basisimmunität ausreichend: 3 Antigenexpositionen (Impfung und/oder Infektion), davon mindestens 1 Impfung
Weitere Auffrischimpfung(en) i. d. R. in einem Abstand von ≥ 12 Monaten zur letzten bekannten Antigenexposition; vorzugsweise im Herbst
18-59 Jahre
Ja
Nein
Schwangere ohne Grunderkrankung ab 2. Trimenon
Ja
Alter ≥ 6 Monate
mit Grundkrankheiten (einschl. Immundefizienz)
Ja
Ja
Personen ≥ 60 Jahre
Ja
Medizinisches und pflegendes Personal mit direktem Kontakt sowie Familienangehörige und enge Kontaktpersonen von Immunsupprimierten
Ja
Bewohnerinnen und Bewohner in Einrichtungen der Pflege
Ja
Tabelle 1: Impftabelle für die COVID-19-Immunisierung der STIKO. Alle Impfungen sollten mit einem zugelassenen mRNA-, oder Protein-basierten Impfstoff mit jeweils von der WHO empfohlenen Variantenanpassung geschehen (Robert Koch-Institut, 2024). Eigene Darstellung.
Kritik an den STIKO-Empfehlungen
ÄFI hat aus folgenden Gründen in einem offenen Brief an die STIKO sowie in einer neuen Stellungnahme Für ein Umdenken in der Impfpolitik Anfang 2023 die Rücknahme der Impf-Empfehlungen für unter 60-Jährige gefordert:
- Die genaue Angabe der enthaltenen modifizierten mRNA in Mikrogramm pro verabreichter Dosis täuscht darüber hinweg, dass weder die genaue funktionelle Menge an modifizierter mRNA damit angegeben noch die vom Patienten produzierte Antigenmenge genau definiert ist. Hierzu können weder Hersteller noch Zulassungsbehörden eindeutige Angaben machen.
- Seit der Omikron-Variante (bereits seit Anfang 2022, aber vor allem in der Herbst-Erkältungssaison 2022) spielt SARS-CoV-2 für das Infektionsgeschehen nur noch eine Nebenrolle (Anteil am Infektgeschehen ca. 8 %).
- Speziell für Kinder belegt die Veröffentlichung der Deutschen Gesellschaft für Pädiatrische Infektiologie e. V., dass andere Viruserkrankungen wie RSV und Influenza im Fokus stehen (Deutsche Gesellschaft für Pädiatrische Infektiologie e. V., 2023).
- Eine Infektion ist gegenüber der reinen Impfserie (2- oder 3-fach) als mindestens gleichwertig zu bewerten (Medić et al., 2022; Stein et al., 2023).
- Die Studie von Bowe, Yie & Al- Aly (2022) zeigt eindeutig auch für die ursprünglich identifizierten Risikogruppen mit bestimmten Grunderkrankungen, dass das Risiko, zu versterben, bei geimpften reinfizierten Individuen höher als bei ungeimpften reinfizierten Individuen ist (Bowe et al., 2022).
- COVID-19-Impfungen haben relevante Nebenwirkungen, die dringend näher erforscht werden müssen, um eine generelle Nutzen-Risiko-Abwägung zu ermöglichen.
- Eine bereits im Juni 2022 im Fachjournal The Lancet veröffentlichte englische Studie zeigt auf, dass Long-Covid bei einer Durchbruchsinfektion seltener wird, je länger die letzte Impfung gegen Corona zurückliegt (Antonelli et al., 2022).
- Die WHO hat im März 2023 ihre Empfehlungen für Auffrischungsimpfungen überarbeitet: Hohe Priorität hätten demnach nur noch ältere Erwachsene, jüngere Erwachsene mit erheblichen Begleiterkrankungen (z. B. Diabetes und Herzerkrankungen), Menschen mit geschwächtem Immunsystem (z. B. HIV-Infizierte und Transplantatempfänger), einschließlich Kinder ab 6 Monaten, Schwangere und medizinisches Fachpersonal (World Health Organization, 2023b).
- COVID-19: Die einrichtungsbezogene Impfpflicht
Vom 16. März bis 31. Dezember 2022 gab es in Deutschland eine einrichtungsbezogene Impfpflicht für COVID-19-Impfungen.
Beschäftigte in Krankenhäusern, Pflegeheimen oder medizinischen Einrichtungen mussten bis zum 31. September grundsätzlich „vollständig geimpft“ sein (zwei Impfungen) oder einen Genesenennachweis erbringen. Dieser war jedoch nach Verkürzung durch das RKI bei ungeimpften Menschen nur drei Monate gültig. Konnten diese Menschen keinen ausreichenden Impfschutz vorweisen, musste dies der Arbeitgeber an das zuständige Gesundheitsamt melden. Dem Gesundheitsamt oblag dann, den Impfnachweis einzufordern. Hierfür wurde dem Betroffenen ein Monat Zeit zugebilligt. Dieser Forderung konnte mit Betretungsverboten und Strafzahlungen bis zu 2.500 Euro Nachdruck verliehen werden. Ab 1. Oktober 2022 galten Menschen mit drei Impfungen als „vollständig geimpft“. Ein Genesenennachweis nach der letzten Impfung konnte die dritte Impfung ersetzen.
Die Umsetzung der einrichtungsbezogenen Impfpflicht wurde in den Bundesländern unterschiedlich gehandhabt. Teilweise wurde die Impfpflicht nicht kontrolliert bzw. bei der Vollständigkeit der Grundimmunisierung (2 oder 3 Impfungen) unterschieden.Ziel der einrichtungsbezogenen Impfpflicht war es laut Politik, ein Zusammenbrechen des Gesundheitssystems zu verhindern und den Schutz vulnerabler Gruppen (Ältere und Kranke) zu gewährleisten. Aufgrund der sich im zeitlichen Verlauf immer weiter reduzierenden Effektivität der Impfstoffe zur Verhinderung der Transmission (s. Effektivität der Impfstrategie) stand sie jedoch massiv in der Kritik und wurde so letztlich Ende 2022 nicht verlängert.
Zugleich hat das Gesetz sehr viel Leid bei den Betroffenen verursacht, wie ÄFI durch das Sammeln von über 1000 Geschichten und Statements von Fachkräften im Gesundheitswesen sowie die Veröffentlichung von 320 dieser Schicksale in Form des Buches Die Corona-Impfpflicht ist das falsche Instrument dokumentiert hat. Bei einer Unterschriftenaktion des Vereins haben sich rund 37.000 Menschen gegen die einrichtungsbezogene Impfpflicht ausgesprochen.
Letztlich könnte die einrichtungsbezogene Impfpflicht sogar kontraproduktiv gewesen sein: Eine September 2023 veröffentlichte, im Rahmen der prospektiven Kohortenstudie CoVacSer durchgeführte Befragung mit 1.704 Beschäftigten des Gesundheitswesens ergab mittels eines elektronischen Fragebogens, dass mehr als ein Drittel der Befragten (595 bzw. 34,9 %) mindestens ein Mal nach einer Corona-Impfung krankgeschrieben waren. Dies entsprach einer Gesamtzahl von 1.550 Krankheitstagen. Sowohl die absoluten Krankheitstage als auch der Anteil der Beschäftigten nahm mit jeder zusätzlichen Impfung zu. Insbesondere nach der dritten Moderna-Impfung (Spikevax) wurden signifikant längere und häufigere Krankenstände festgestellt. Die Autoren folgern, dass weitere Booster in Personalengpässen resultieren könnten, wodurch das ohnehin schon angespannte Gesundheitssystem weiter belastet und die angemessene Patientenversorgung gestört werden könnte (Reusch et al., 2023).
Unsere Stellungnahme an den Gesundheitsausschuss des Deutschen Bundestages zur einrichtungsbezogenen Impfpflicht können Sie hier nachlesen, die Stellungnahme als Sachverständiger Dritter an das Bundesverfassungsgericht hier. Außerdem finden Sie hier das Gutachten von Prof. Dr. Dr. Volker Boehme-Neßler: „Die einrichtungsbezogene Corona-Impfpflicht ist verfassungswidrig!“
- COVID-19: Arbeitspapier zu Long-COVID und Post-Vac
Von Dr. med. Erich Freisleben und Dr. med. Anne-Kathrin Brüggemann
Langzeitfolgen der COVID-19-Erkrankung und das nach einer Impfung gegen COVID-19 mögliche Post-Vac-Syndrom ähneln sich in vielerlei Hinsicht. Mit diesem Arbeitspapier möchte ÄFI die hausärztliche Praxis in Diagnostik und Therapie beider Syndrome unterstützen.
Es ist auf der folgenden Grundlage entstanden:
- Befragungen Betroffener und ihrer Angehörigen (Kontakt über Selbsthilfegruppen und Patientenvertretungen)
- Fallkonferenzen mit Betroffenen und ihren Behandelnden
- Auswertung von ca. 300 Patientenfällen der Praxis von Dr. Erich Freisleben
- Online-Befragungen behandelnder Hausarztpraxen (Praxen n=62, Gesamtzahl betroffener Patienten und Patientinnen dieser Praxen n=934)
- Online- und Präsenzveranstaltungen mit internationalem und interdisziplinärem Fachpersonal aus medizinischen Berufen und interdisziplinären Wissenschaftlern zur gegenseitigen Fortbildung und zum direkten Austausch zu Diagnostik und Therapie
- Aktuell verfügbare Fachliteratur
- Vernetzung und Koordination der nationalen und internationalen Teilnehmer durch Dr. med. Anne-Katrin Brüggemann
Das Arbeitspapier versteht sich als eine der Evidenz verpflichtete Grundlage. Es kann daher weder als vollständig noch als abschließend betrachtet werden. Vielmehr bietet es eine erste wissenschaftliche Handlungsempfehlung für die hausärztliche Praxis, die bei neuer Evidenz angepasst wird.
Lesen Sie dazu bitte hier weiter.
- COVID-19: Für ein Umdenken in der Impfpolitik
Das ÄFI-Positionspapier: Für ein Umdenken in der Impfpolitik
Die Maßnahmen zur Bewältigung der Corona-Pandemie waren einseitig ausgerichtet: Die Massenimpfungen sollten unbedingt durchgesetzt werden, obwohl ihre Wirksamkeit und Sicherheit nur unzureichend untersucht worden waren. Die Ärztinnen und Ärzte für individuelle Impfentscheidung e. V. (ÄFI) fordern eine fachwissenschaftliche Aufarbeitung, evidenzbasierte Impfempfehlungen und eine Neuausrichtung von RKI, STIKO und PEI.
Mit Beginn der Corona-Pandemie wurden Impfungen zum entscheidenden Mittel der Pandemiebewältigung erklärt. Die Zulassung der modRNA-basierten Impfstoffe verletzte jedoch bewährte Standards: Beschleunigte Verfahren für eine bedingte Zulassung suggerierten Sicherheit, obwohl der Nachweis hierfür vorab und bis heute nicht erbracht wurde.
Die Impfstrategie in Deutschland beruhte auf unzureichenden und teilweise falschen Daten zu Infektionen und Erkrankungen. Die Auswirkungen der neuartigen Impfstoffe werden erst nach und nach verstanden. Der Einfluss des auf der Basis von eingebrachter modRNA und im Organismus hergestellten Spike-Proteins auf Gefäßrezeptoren könnte ursächlich für die zahlreichen beobachteten Nebenwirkungen bzw. für das sogenannte Post-Vac-Syndrom sein.
Institutionen mit Kontrollfunktion für Impfung und Impfstrategie geben sich wissenschaftlich unabhängig. In der Praxis sind sie jedoch politischen Weisungen unterworfen (Robert Koch-Institut - RKI) oder sehen sich dem Druck von Politik und pharmazeutischer Industrie ausgesetzt (Ständige Impfkommission - STIKO). Dies hat zu einem massiven Vertrauensverlust in die Institutionen wie auch gegenüber Impfstoffen geführt.
Bitte lesen Sie hier weiter.
- Literaturverzeichnis
Abbasi, J. (2023). What to Know About EG.5, the Latest SARS-CoV-2 “Variant of Interest”. JAMA, 330(10), 900–901. https://doi.org/10.1001/jama.2023.16498
Agarwal, G., Hajra, A., Chakraborty, S., Patel, N., Biswas, S., Adler, M. K., & Lavie, C. J. (2022). Predictors and mortality risk of venous thromboembolism in patients with COVID-19: Systematic review and meta-analysis of observational studies. Therapeutic Advances in Cardiovascular Disease, 16, 17539447221105012. https://doi.org/10.1177/17539447221105013
Akbarialiabad, H., Taghrir, M. H., Abdollahi, A., Ghahramani, N., Kumar, M., Paydar, S., Razani, B., Mwangi, J., Asadi-Pooya, A. A., Malekmakan, L., & Bastani, B. (2021). Long COVID, a comprehensive systematic scoping review. Infection, 49(6), 1163–1186. https://doi.org/10.1007/s15010-021-01666-x
Alimohamadi, Y., Tola, H. H., Abbasi-Ghahramanloo, A., Janani, M., & Sepandi, M. (2021). Case fatality rate of COVID-19: A systematic review and meta-analysis. Journal of Preventive Medicine and Hygiene, 62(2), E311–E320. https://doi.org/10.15167/2421-4248/jpmh2021.62.2.1627
Almamlouk, R., Kashour, T., Obeidat, S., Bois, M. C., Maleszewski, J. J., Omrani, O. A., Tleyjeh, R., Berbari, E., Chakhachiro, Z., Zein-Sabatto, B., Gerberi, D., Tleyjeh, I. M., Cardiac Autopsy in COVID-19 Study Group, Paniz Mondolfi, A. E., Finn, A. V., Duarte-Neto, A. N., Rapkiewicz, A. V., Frustaci, A., Keresztesi, A.-A., … Grimes, Z. (2022). COVID-19-Associated cardiac pathology at the postmortem evaluation: A collaborative systematic review. Clinical Microbiology and Infection: The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases, 28(8), 1066–1075. https://doi.org/10.1016/j.cmi.2022.03.021
Andersson, N. W., Thiesson, E. M., Lassaunière, R., Hansen, J. V., & Hviid, A. (2023). Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Infection and Postacute Risk of Non–Coronavirus Disease 2019 Infectious Disease Hospitalizations: A Nationwide Cohort Study of Danish Adults Aged ≥50 Years. Clinical Infectious Diseases, ciad531. https://doi.org/10.1093/cid/ciad531
Antonelli, M., Pujol, J. C., Spector, T. D., Ourselin, S., & Steves, C. J. (2022). Risk of long COVID associated with delta versus omicron variants of SARS-CoV-2. Lancet (London, England), 399(10343), 2263–2264. https://doi.org/10.1016/S0140-6736(22)00941-2
Arbel, R., Hammerman, A., & Netzer, D. (2023). Bivalent Boosters against Severe Omicron Infection. New England Journal of Medicine, 388(18), 1726–1727. https://doi.org/10.1056/NEJMc2303753
Barrett, R., Youssef, M., Shah, I., Ioana, J., Lawati, A. A., Bukhari, A., Hegarty, S., Cormican, L. J., Judge, E., Burke, C. M., Cody, C., Feely, J., Hutchinson, K., Tormey, W., Neill, E. O., Shea, A. O., Connolly, M., McCartney, D. M. A., & Faul, J. L. (2022). Vitamin D Status and Mortality from SARS CoV-2: A Prospective Study of Unvaccinated Caucasian Adults. Nutrients, 14(16), 3252. https://doi.org/10.3390/nu14163252
Bazargan, M., Elahi, R., & Esmaeilzadeh, A. (2022). OMICRON: Virology, immunopathogenesis, and laboratory diagnosis. The Journal of Gene Medicine, 24(7), e3435. https://doi.org/10.1002/jgm.3435
Benn, C. S., Schaltz-Buchholzer, F., Nielsen, S., Netea, M. G., & Aaby, P. (2023). Randomized clinical trials of COVID-19 vaccines: Do adenovirus-vector vaccines have beneficial non-specific effects? IScience, 26(5). https://doi.org/10.1016/j.isci.2023.106733
Bobrovitz, N., Ware, H., Ma, X., Li, Z., Hosseini, R., Cao, C., Selemon, A., Whelan, M., Premji, Z., Issa, H., Cheng, B., Abu Raddad, L. J., Buckeridge, D. L., Van Kerkhove, M. D., Piechotta, V., Higdon, M. M., Wilder-Smith, A., Bergeri, I., Feikin, D. R., … Subissi, L. (2023). Protective effectiveness of previous SARS-CoV-2 infection and hybrid immunity against the omicron variant and severe disease: A systematic review and meta-regression. The Lancet. Infectious Diseases, S1473-3099(22)00801-5. https://doi.org/10.1016/S1473-3099(22)00801-5
Bodderas, E. (2022, Dezember 15). „US-Gesundheitsbehörde ließ sich von acht Labormäusen überzeugen“. DIE WELT. https://www.welt.de/politik/deutschland/plus241005455/Corona-Impfung-US-Gesundheitsbehoerde-liess-sich-von-acht-Labormaeusen-ueberzeugen.html
Bodderas, E., Lübberding, F., Röhn, T., & Stibi, B. (2022, Juli 6). Corona-Impfung: 2,5 Millionen Patienten meldeten Nebenwirkungen in Deutschland—WELT. DIE WELT. https://www.welt.de/politik/deutschland/plus239736199/Corona-Impfung-2-5-Millionen-Patienten-meldeten-Nebenwirkungen-in-Deutschland.html
Bourdas, D. I., Bakirtzoglou, P., Travlos, A. K., Andrianopoulos, V., & Zacharakis, E. (2023). Exploring the Impact of COVID-19 on Physical Activity One Month after Infection and Its Potential Determinants: Re-Infections, Pre-Illness Vaccination Profiles/Types, and Beyond. Vaccines, 11(9), Article 9. https://doi.org/10.3390/vaccines11091431
Bowe, B., Xie, Y., & Al-Aly, Z. (2022). Acute and postacute sequelae associated with SARS-CoV-2 reinfection. Nature Medicine, 28(11), 2398–2405. https://doi.org/10.1038/s41591-022-02051-3
Brown, M., Gerrard, J., McKinlay, L., Marquess, J., Sparrow, T., & Andrews, R. (2023). Ongoing symptoms and functional impairment 12 weeks after testing positive to SARS-CoV-2 or influenza in Australia: An observational cohort study (S. 2023.04.16.23288205). medRxiv. https://doi.org/10.1101/2023.04.16.23288205
Bundesministerium für Gesundheit. (2023, März 4). Impfdashboard. impfdashboard.de. https://impfdashboard.de/
Bundeszentrale für gesundheitliche Aufklärung. (2022, November 10). Infektion mit dem Coronavirus: Symptome und Krankheitsverlauf. infektionsschutz.de. https://www.infektionsschutz.de/coronavirus/basisinformationen/symptome-und-krankheitsverlauf/
Callaway, E. (2022). New Omicron-specific vaccines offer similar protection to existing boosters. Nature, 609(7926), 232–233. https://doi.org/10.1038/d41586-022-02806-5
Chebotareva, N., Berns, S., Androsova, T., & Moiseev, S. (2021). Acute kidney damage in COVID-19 patients. Clinical Nephrology, 95(5), 227–239. https://doi.org/10.5414/CN110357
Chen, C., Haupert, S. R., Zimmermann, L., Shi, X., Fritsche, L. G., & Mukherjee, B. (2022). Global Prevalence of Post-Coronavirus Disease 2019 (COVID-19) Condition or Long COVID: A Meta-Analysis and Systematic Review. The Journal of Infectious Diseases, 226(9), 1593–1607. https://doi.org/10.1093/infdis/jiac136
Cheung, C., & Cheung, B. M. Y. (2021). Vitamin D and COVID-19: Causal factor or bystander? Postgraduate Medical Journal, 97(1149), 413–414. https://doi.org/10.1136/postgradmedj-2020-139388
Cho, J. Y., Kim, K. H., Lee, N., Cho, S. H., Kim, S. Y., Kim, E. K., Park, J.-H., Choi, E.-Y., Choi, J.-O., Park, H., Kim, H. Y., Yoon, H. J., Ahn, Y., Jeong, M. H., & Cho, J. G. (2023). COVID-19 vaccination-related myocarditis: A Korean nationwide study. European Heart Journal, ehad339. https://doi.org/10.1093/eurheartj/ehad339
Cross, R. (2021, März 6). Without these lipid shells, there would be no mRNA vaccines for COVID-19. American Chemical Society. https://cen.acs.org/pharmaceuticals/drug-delivery/Without-lipid-shells-mRNA-vaccines/99/i8
Del Águila-Mejía, J., Wallmann, R., Calvo-Montes, J., Rodríguez-Lozano, J., Valle-Madrazo, T., & Aginagalde-Llorente, A. (2022). Secondary Attack Rate, Transmission and Incubation Periods, and Serial Interval of SARS-CoV-2 Omicron Variant, Spain. Emerging Infectious Diseases, 28(6), 1224–1228. https://doi.org/10.3201/eid2806.220158
Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin e.V., Deutsche Gesellschaft für Internistische Intensivmedizin und Notfallmedizin e.V., Deutsche Gesellschaft für Infektiologie e.V., Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin e.V., Deutsche Gesellschaft für Innere Medizin e.V., Deutsche Gesellschaft für Pädiatrische Infektiologie e.V., Deutsche Gesellschaft für Rheumatologie e.V., Deutsche Gesellschaft für Kinder- und Jugendmedizin e.V., & Deutsche AIDS-Gesellschaft e.V. (2023, Februar 1). S2e-Leitlinie SARS-CoV-2 / Covid-19 Informationen und Praxishilfen für niedergelassene Hausärztinnen und Hausärzte—Living Guideline. AWMF Leitlinien Register. https://register.awmf.org/de/leitlinien/detail/053-054
Deutsche Gesellschaft für Pädiatrische Infektiologie e. V. (2023). Ad hoc Atemwegsinfektions-Erfassung, wöchentliches Update. DGPI. https://dgpi.de/awi-erfassung-update/
Deutsche Interdisziplinäre Vereinigung für Intensiv- und Notfallmedizin (DIVI) e.V. & Robert Koch-Institut. (2024, Januar 25). Zeitreihen. intensivregister.de. https://www.intensivregister.de/#/aktuelle-lage/zeitreihen
Deutsches Ärzteblatt. (2023, Februar 2). Immune Imprinting: Kann Impfen Sünde sein? aerzteblatt.de. https://www.aerzteblatt.de/nachrichten/140205/Immune-Imprinting-Kann-Impfen-Suende-sein
Dingermann, T. (2023, August 18). Angepasste Covid-19-Impfstoffe wirksam gegen EG.5. Pharmazeutische Zeitung online. https://www.pharmazeutische-zeitung.de/angepasste-covid-19-impfstoffe-wirksam-gegen-eg5-141829/
Duijster, J. W., Schoep, M. E., Nieboer, T. E., Jajou, R., Kant, A., & Van Hunsel, F. (2023). Menstrual abnormalities after COVID-19 vaccination in the Netherlands: A description of spontaneous and longitudinal patient-reported data. British Journal of Clinical Pharmacology. https://doi.org/10.1111/bcp.15799
Dun-Dery, F., Xie, J., Winston, K., Burstein, B., Gravel, J., Emsley, J., Sabhaney, V., Zemek, R., Berthelot, S., Beer, D., Kam, A., Freire, G., Mater, A., Porter, R., Poonai, N., Moffatt, A., Dixon, A., Salvadori, M. I., Freedman, S. B., & Pediatric Emergency Research Canada (PERC) COVID Study Group. (2023). Post–COVID-19 Condition in Children 6 and 12 Months After Infection. JAMA Network Open, 6(12), e2349613. https://doi.org/10.1001/jamanetworkopen.2023.49613
Erbguth, F., Förstl, H., & Kleinschnitz, C. (2023, März 31). Long COVID und die Psycho-Ecke: Wiedergeburt eines reduktionistischen Krankheitsverständnisses. Deutsches Ärzteblatt. https://www.aerzteblatt.de/archiv/230476/Long-COVID-und-die-Psycho-Ecke-Wiedergeburt-eines-reduktionistischen-Krankheitsverstaendnisses
Europäische Kommission. (2022, September 2). EU-Kommission lässt angepasste Impfstoffe von BioNTech und Moderna zu. EU-Kommission. https://germany.representation.ec.europa.eu/news/eu-kommission-lasst-angepasste-impfstoffe-von-biontech-und-moderna-zu-2022-09-02_de
Euser, S., Aronson, S., Manders, I., van Lelyveld, S., Herpers, B., Sinnige, J., Kalpoe, J., van Gemeren, C., Snijders, D., Jansen, R., Schuurmans Stekhoven, S., van Houten, M., Lede, I., Cohen Stuart, J., Slijkerman Megelink, F., Kapteijns, E., den Boer, J., Sanders, E., Wagemakers, A., & Souverein, D. (2022). SARS-CoV-2 viral-load distribution reveals that viral loads increase with age: A retrospective cross-sectional cohort study. International Journal of Epidemiology, 50(6), 1795–1803. https://doi.org/10.1093/ije/dyab145
Faksova, K., Walsh, D., Jiang, Y., Griffin, J., Phillips, A., Gentile, A., Kwong, J. C., Macartney, K., Naus, M., Grange, Z., Escolano, S., Sepulveda, G., Shetty, A., Pillsbury, A., Sullivan, C., Naveed, Z., Janjua, N. Z., Giglio, N., Perälä, J., … Hviid, A. (2024). COVID-19 vaccines and adverse events of special interest: A multinational Global Vaccine Data Network (GVDN) cohort study of 99 million vaccinated individuals. Vaccine. https://doi.org/10.1016/j.vaccine.2024.01.100
Fan, M., Peng, K., Zhang, Y., Lai, F. T. T., Chui, C. S. L., Wan, E. Y. F., Wong, C. K. H., Chan, E. W. Y., Li, X., & Wong, I. C. K. (2024). Risk of carditis among adolescents after extending the interdose intervals of BNT162b2. Npj Vaccines, 9(1), Article 1. https://doi.org/10.1038/s41541-023-00789-6
Feldt, T., Karagiannidis, C., Mager, S., Mikolajewska, A., Uhrig, A., Witzke, O., Wolf, T., Beutel, G., & Lachmann, G. (2020). Welche Rolle spielt ein mögliches Hyperinflammationssyndrom bei einer schweren COVID-19-Infektion und können hieraus Konsequenzen für die Therapie gezogen werden? Robert Koch-Institut. https://doi.org/10.25646/7037
Feltham, E., Forastiere, L., Alexander, M., & Christakis, N. A. (2023). Mass gatherings for political expression had no discernible association with the local course of the COVID-19 pandemic in the USA in 2020 and 2021. Nature Human Behaviour, 1–21. https://doi.org/10.1038/s41562-023-01654-1
FOCUS online. (2022, Oktober 3). Impfstoff-RNA in Muttermilch: Experten sagen, wie gefährlich das ist. focus.de. https://www.focus.de/gesundheit/coronaimpfung-impfstoff-rna-in-muttermilch-nachgewiesen-was-das-nun-fuer-muetter-bedeutet_id_154659625.html
FOCUS online. (2023, Februar 1). 253 anerkannte Impfschäden – die 6 wichtigsten Fragen. https://www.focus.de/gesundheit/coronavirus/seltene-schwere-nebenwirkungen-253-faelle-in-deutschland-die-6-wichtigsten-fragen-zu-impfschaeden_id_184560185.html
Fox, T., Hunt, B. J., Ariens, R. A., Towers, G. J., Lever, R., Garner, P., & Kuehn, R. (2023). Plasmapheresis to remove amyloid fibrin(ogen) particles for treating the post‐COVID‐19 condition. Cochrane Database of Systematic Reviews, 7. https://doi.org/10.1002/14651858.CD015775
Frutos, A. M., Kuan, G., Lopez, R., Ojeda, S., Shotwell, A., Sanchez, N., Saborio, S., Plazaola, M., Barilla, C., Kenah, E., Balmaseda, A., & Gordon, A. (2022). Infection-induced immunity is associated with protection against SARS-CoV-2 infection, but not decreased infectivity during household transmission. MedRxiv: The Preprint Server for Health Sciences, 2022.10.10.22280915. https://doi.org/10.1101/2022.10.10.22280915
Fu, C., Lin, N., Zhu, J., & Ye, Q. (2023). Association between Overweight/Obesity and the Safety and Efficacy of COVID-19 Vaccination: A Systematic Review. Vaccines, 11(5), Article 5. https://doi.org/10.3390/vaccines11050996
Gabbai-Armelin, P. R., de Oliveira, A. B., Ferrisse, T. M., Sales, L. S., Barbosa, E. R. O., Miranda, M. L., Salomão, K. B., & Brighenti, F. L. (2021). COVID-19 (SARS-CoV-2) infection and thrombotic conditions: A systematic review and meta-analysis. European Journal of Clinical Investigation, 51(6), e13559. https://doi.org/10.1111/eci.13559
Gao, J., Feng, L., Li, Y., Lowe, S., Guo, Z., Bentley, R., Xie, C., Wu, B., Xie, P., Xia, W., Ma, S., Liu, H., Guo, X., Uy, J. P. N., Zhou, Q., Wazir, H., & Sun, C. (2023). A Systematic Review and Meta-analysis of the Association Between SARS-CoV-2 Vaccination and Myocarditis or Pericarditis. American Journal of Preventive Medicine, 64(2), 275–284. https://doi.org/10.1016/j.amepre.2022.09.002
Gießelmann, K., & Martin, M. (2022, Mai 13). Post-Vac-Syndrom: Seltene Folgen nach Impfung. Deutsches Ärzteblatt. https://www.aerzteblatt.de/archiv/225071/Post-Vac-Syndrom-Seltene-Folgen-nach-Impfung
Guemes-Villahoz, N., Burgos-Blasco, B., Echevarria-Torres, P. L., Vidal-Villegas, B., Rodriguez de la Peña, A., Diaz-Valle, D., Fernández-Vigo, J. I., Sánchez-Ramón, S., & Garcia-Feijoo, J. (2023). Detection of anti-SARS-CoV-2 antibodies in tears: Ocular surface immunity to COVID-19. Archivos De La Sociedad Espanola De Oftalmologia, S2173-5794(23)00083-X. https://doi.org/10.1016/j.oftale.2023.05.009
Gustine, J. N., & Jones, D. (2021). Immunopathology of Hyperinflammation in COVID-19. The American Journal of Pathology, 191(1), 4–17. https://doi.org/10.1016/j.ajpath.2020.08.009
Han, Q., Zheng, B., Daines, L., & Sheikh, A. (2022). Long-Term Sequelae of COVID-19: A Systematic Review and Meta-Analysis of One-Year Follow-Up Studies on Post-COVID Symptoms. Pathogens (Basel, Switzerland), 11(2), 269. https://doi.org/10.3390/pathogens11020269
Hanna, N., Heffes-Doon, A., Lin, X., Manzano De Mejia, C., Botros, B., Gurzenda, E., & Nayak, A. (2022). Detection of Messenger RNA COVID-19 Vaccines in Human Breast Milk. JAMA Pediatrics, 176(12), 1268–1270. https://doi.org/10.1001/jamapediatrics.2022.3581
Hanna, N., Mejia, C. M. D., Heffes-Doon, A., Lin, X., Botros, B., Gurzenda, E., Clauss-Pascarelli, C., & Nayak, A. (2023). Biodistribution of mRNA COVID-19 vaccines in human breast milk. eBioMedicine, 96. https://doi.org/10.1016/j.ebiom.2023.104800
Hasan, D., Shono, A., van Kalken, C. K., van der Spek, P. J., Krenning, E. P., & Kotani, T. (2022). A novel definition and treatment of hyperinflammation in COVID-19 based on purinergic signalling. Purinergic Signalling, 18(1), 13–59. https://doi.org/10.1007/s11302-021-09814-6
Hazell, L., & Shakir, S. A. W. (2006). Under-reporting of adverse drug reactions: A systematic review. Drug Safety,29(5), 385–396. https://doi.org/10.2165/00002018-200629050-00003
Health Advisory & Recovery Team. (2022, August 14). Measuring the extent of the Myocarditis Iceberg? Safety lessons from smallpox vaccination. HART. https://www.hartgroup.org/measuring-the-extent-of-the-myocarditis-iceberg/
Hirt, J., Janiaud, P., Gloy, V. L., Schandelmaier, S., Pereira, T. V., Contopoulos-Ioannidis, D., Goodman, S. N., Ioannidis, J., Munkholm, K., & Hemkens, L. G. (2022). Robustness of reported postacute health outcomes in children with SARS-CoV-2 infection: A systematic review. Archives of Disease in Childhood, archdischild-2022-324455. https://doi.org/10.1136/archdischild-2022-324455
Husby, A., Gulseth, H. L., Hovi, P., Hansen, J. V., Pihlström, N., Gunnes, N., Härkänen, T., Dahl, J., Karlstad, Ø., Heliö, T., Køber, L., Ljung, R., & Hviid, A. (2023). Clinical outcomes of myocarditis after SARS-CoV-2 mRNA vaccination in four Nordic countries: Population based cohort study. BMJ Medicine, 2(1), e000373. https://doi.org/10.1136/bmjmed-2022-000373
Høeg, T. B., Duriseti, R., & Prasad, V. (2023). Potential “Healthy Vaccinee Bias” in a Study of BNT162b2 Vaccine against Covid-19. New England Journal of Medicine, 389(3), 284–286. https://doi.org/10.1056/NEJMc2306683
Institute for Health Metrics and Evaluation. (2021, März 4). COVID-19 vaccine efficacy summary. IHME. https://www.healthdata.org/covid/covid-19-vaccine-efficacy-summary
Jones, S. E., Maisha, F. I., Strausz, S. J., Lammi, V., Cade, B. E., Tervi, A., Helaakoski, V., Broberg, M. E., FinnGen, Lane, J. M., Redline, S., Saxena, R., & Ollila, H. M. (2023). The public health impact of poor sleep on severe COVID-19, influenza and upper respiratory infections. EBioMedicine, 104630. https://doi.org/10.1016/j.ebiom.2023.104630
Jones, T. C., Biele, G., Mühlemann, B., Veith, T., Schneider, J., Beheim-Schwarzbach, J., Bleicker, T., Tesch, J., Schmidt, M. L., Sander, L. E., Kurth, F., Menzel, P., Schwarzer, R., Zuchowski, M., Hofmann, J., Krumbholz, A., Stein, A., Edelmann, A., Corman, V. M., & Drosten, C. (2021). Estimating infectiousness throughout SARS-CoV-2 infection course. Science, 373(6551), eabi5273. https://doi.org/10.1126/science.abi5273
Jordan, T., Siuka, D., Rotovnik, N. K., & Pfeifer, M. (2022). COVID-19 and Vitamin D- a Systematic Review. Zdravstveno Varstvo, 61(2), 124–132. https://doi.org/10.2478/sjph-2022-0017
Karlstad, Ø., Hovi, P., Husby, A., Härkänen, T., Selmer, R. M., Pihlström, N., Hansen, J. V., Nohynek, H., Gunnes, N., Sundström, A., Wohlfahrt, J., Nieminen, T. A., Grünewald, M., Gulseth, H. L., Hviid, A., & Ljung, R. (2022). SARS-CoV-2 Vaccination and Myocarditis in a Nordic Cohort Study of 23 Million Residents. JAMA Cardiology, 7(6), 600–612. https://doi.org/10.1001/jamacardio.2022.0583
Karyakarte, R. P., Das, R., Rajmane, M. V., Dudhate, S., Agarasen, J., Pillai, P., Chandankhede, P. M., Labhshetwar, R. S., Gadiyal, Y., Kulkarni, P. P., Nizarudeen, S., Joshi, S., Karmodiya, K., & Potdar, V. (2023). Chasing SARS-CoV-2 XBB.1.16 Recombinant Lineage in India and the Clinical Profile of XBB.1.16 Cases in Maharashtra, India. Cureus, 15(6), e39816. https://doi.org/10.7759/cureus.39816
Khoury, D. S., Docken, S. S., Subbarao, K., Kent, S. J., Davenport, M. P., & Cromer, D. (2023). Predicting the efficacy of variant-modified COVID-19 vaccine boosters. Nature Medicine, 29(3), 574–578. https://doi.org/10.1038/s41591-023-02228-4
Kim, K., Cho, K., Song, J., Rahmati, M., Koyanagi, A., Lee, S. W., Yon, D. K., Il Shin, J., & Smith, L. (2023). The case fatality rate of COVID-19 during the Delta and the Omicron epidemic phase: A meta-analysis. Journal of Medical Virology, 95(2), e28522. https://doi.org/10.1002/jmv.28522
Klugar, M., Riad, A., Mekhemar, M., Conrad, J., Buchbender, M., Howaldt, H.-P., & Attia, S. (2021). Side Effects of mRNA-Based and Viral Vector-Based COVID-19 Vaccines among German Healthcare Workers. Biology, 10(8), 752. https://doi.org/10.3390/biology10080752
Ko, L., Malet, G., Chang, L. L., Nguyen, H., Mayes, R., Ko, L., Malet, G., Chang, L., Nguyen, H., & Mayes, R. (2023). COVID-19 Infection Rates in Vaccinated and Unvaccinated Inmates: A Retrospective Cohort Study. Cureus, 15(9). https://doi.org/10.7759/cureus.44684
Krauson, A. J., Casimero, F. V. C., Siddiquee, Z., & Stone, J. R. (2023). Duration of SARS-CoV-2 mRNA vaccine persistence and factors associated with cardiac involvement in recently vaccinated patients. NPJ Vaccines, 8(1), 141. https://doi.org/10.1038/s41541-023-00742-7
Kurhade, C., Zou, J., Xia, H., Liu, M., Chang, H. C., Ren, P., Xie, X., & Shi, P.-Y. (2023). Low neutralization of SARS-CoV-2 Omicron BA.2.75.2, BQ.1.1 and XBB.1 by parental mRNA vaccine or a BA.5 bivalent booster. Nature Medicine, 29(2), 344–347. https://doi.org/10.1038/s41591-022-02162-x
Lasrado, N., Collier, A.-R. Y., Miller, J., Hachmann, N. P., Liu, J., Sciacca, M., Wu, C., Anand, T., Bondzie, E. A., Fisher, J. L., Mazurek, C. R., Patio, R. C., Powers, O., Rodrigues, S. L., Rowe, M., Surve, N., Ty, D. M., Korber, B., & Barouch, D. H. (2023). Waning Immunity Against XBB.1.5 Following Bivalent mRNA Boosters. BioRxiv: The Preprint Server for Biology, 2023.01.22.525079. https://doi.org/10.1101/2023.01.22.525079
Lewnard, J. A., Hong, V., Kim, J. S., Shaw, S. F., Lewin, B., Takhar, H., & Tartof, S. Y. (2023). Association of SARS-CoV-2 BA.4/BA.5 Omicron lineages with immune escape and clinical outcome. Nature Communications, 14(1), 1407. https://doi.org/10.1038/s41467-023-37051-5
Li, H.-J., Yang, Q.-C., Yao, Y.-Y., Huang, C.-Y., Yin, F.-Q., Xian-Yu, C.-Y., Zhang, C., & Chen, S.-J. (2023). COVID-19 vaccination effectiveness and safety in vulnerable populations: A meta-analysis of 33 observational studies. Frontiers in Pharmacology, 14, 1144824. https://doi.org/10.3389/fphar.2023.1144824
Lippi, G., Sanchis-Gomar, F., & Henry, B. M. (2023). COVID-19 and its long-term sequelae: What do we know in 2023? Polish Archives of Internal Medicine, 16402. https://doi.org/10.20452/pamw.16402
Lopez-Leon, S., Wegman-Ostrosky, T., Perelman, C., Sepulveda, R., Rebolledo, P. A., Cuapio, A., & Villapol, S. (2021). More than 50 long-term effects of COVID-19: A systematic review and meta-analysis. Scientific Reports, 11(1), 16144. https://doi.org/10.1038/s41598-021-95565-8
Lyngse, F. P., Mortensen, L. H., Denwood, M. J., Christiansen, L. E., Møller, C. H., Skov, R. L., Spiess, K., Fomsgaard, A., Lassaunière, R., Rasmussen, M., Stegger, M., Nielsen, C., Sieber, R. N., Cohen, A. S., Møller, F. T., Overvad, M., Mølbak, K., Krause, T. G., & Kirkeby, C. T. (2022). Household transmission of the SARS-CoV-2 Omicron variant in Denmark. Nature Communications, 13(1), Article 1. https://doi.org/10.1038/s41467-022-33328-3
Ma, Q., Liu, J., Liu, Q., Kang, L., Liu, R., Jing, W., Wu, Y., & Liu, M. (2021). Global Percentage of Asymptomatic SARS-CoV-2 Infections Among the Tested Population and Individuals With Confirmed COVID-19 Diagnosis: A Systematic Review and Meta-analysis. JAMA Network Open, 4(12), e2137257. https://doi.org/10.1001/jamanetworkopen.2021.37257
Madewell, Z. J., Yang, Y., Longini, I. M., Halloran, M. E., & Dean, N. E. (2022). Household Secondary Attack Rates of SARS-CoV-2 by Variant and Vaccination Status: An Updated Systematic Review and Meta-analysis. JAMA Network Open, 5(4), e229317. https://doi.org/10.1001/jamanetworkopen.2022.9317
Madhi, S. A., Ihekweazu, C., Rees, H., & Pollard, A. J. (2022). Decoupling of omicron variant infections and severe COVID-19. Lancet (London, England), 399(10329), 1047–1048. https://doi.org/10.1016/S0140-6736(22)00109-X
Magnusson, K., Turkiewicz, A., Flottorp, S. A., & Englund, M. (2023). Prevalence of long COVID complaints in persons with and without COVID-19. Scientific Reports, 13(1), Article 1. https://doi.org/10.1038/s41598-023-32636-y
Mahase, E. (2023). Covid-19: New “Pirola” variant BA.2.86 continues to spread in UK and US. BMJ, 382, p2097. https://doi.org/10.1136/bmj.p2097
Malato, J., Ribeiro, R. M., Leite, P. P., Casaca, P., Fernandes, E., Antunes, C., Fonseca, V. R., Gomes, M. C., & Graca, L. (2022). Risk of BA.5 Infection among Persons Exposed to Previous SARS-CoV-2 Variants. The New England Journal of Medicine, 387(10), 953–954. https://doi.org/10.1056/NEJMc2209479
Mansanguan, S., Charunwatthana, P., Piyaphanee, W., Dechkhajorn, W., Poolcharoen, A., & Mansanguan, C. (2022). Cardiovascular Manifestation of the BNT162b2 mRNA COVID-19 Vaccine in Adolescents. Tropical Medicine and Infectious Disease, 7(8), 196. https://doi.org/10.3390/tropicalmed7080196
Mansory, E. M., Abu-Farhaneh, M., Iansavitchene, A., & Lazo-Langner, A. (2022). Venous and Arterial Thrombosis in Ambulatory and Discharged COVID-19 Patients: A Systematic Review and Meta-analysis. TH Open: Companion Journal to Thrombosis and Haemostasis, 6(3), e276–e282. https://doi.org/10.1055/a-1913-4377
Matysik, J. (2023, Februar 24). Biontech-Impfstoff: Kein Polydispersitätstest vom Paul-Ehrlich-Institut. Berliner Zeitung. https://www.berliner-zeitung.de/wirtschaft-verantwortung/corona-pandemie-gastbeitrag-biontech-impfstoff-kein-polydispersitaetstest-vom-paul-ehrlich-institut-li.321577
MDR. (2021, September 30). Stimmt nicht: Es gibt eine unfreiweillige Corona-Impfung via Muttermilch. mdr.de. https://www.mdr.de/wissen/faktencheck/faktencheck-impfung-muttermilch-100.html
Meah, S., Shi, X., Fritsche, L. G., Salvatore, M., Wagner, A., Martin, E. T., & Mukherjee, B. (2023). Design and analysis heterogeneity in observational studies of COVID-19 booster effectiveness: A review and case study. Science Advances, 9(51), eadj3747. https://doi.org/10.1126/sciadv.adj3747
Medić, S., Anastassopoulou, C., Lozanov-Crvenković, Z., Vuković, V., Dragnić, N., Petrović, V., Ristić, M., Pustahija, T., Gojković, Z., Tsakris, A., & Ioannidis, J. P. A. (2022). Risk and severity of SARS-CoV-2 reinfections during 2020–2022 in Vojvodina, Serbia: A population-level observational study. The Lancet Regional Health – Europe, 20. https://doi.org/10.1016/j.lanepe.2022.100453
Mehrabi Nejad, M.-M., Moosaie, F., Dehghanbanadaki, H., Haji Ghadery, A., Shabani, M., Tabary, M., Aryannejad, A., SeyedAlinaghi, S., & Rezaei, N. (2022). Immunogenicity of COVID-19 mRNA vaccines in immunocompromised patients: A systematic review and meta-analysis. European Journal of Medical Research, 27(1), 23. https://doi.org/10.1186/s40001-022-00648-5
Menegale, F., Manica, M., Zardini, A., et al. (2023). Evaluation of Waning of SARS-CoV-2 Vaccine–Induced Immunity: A Systematic Review and Meta-analysis. JAMA Netw Open, 6(5), e2310650. https://10.1001/jamanetworkopen.2023.10650
Michelen, M., Manoharan, L., Elkheir, N., Cheng, V., Dagens, A., Hastie, C., O’Hara, M., Suett, J., Dahmash, D., Bugaeva, P., Rigby, I., Munblit, D., Harriss, E., Burls, A., Foote, C., Scott, J., Carson, G., Olliaro, P., Sigfrid, L., & Stavropoulou, C. (2021). Characterising long COVID: A living systematic review. BMJ Global Health, 6(9), e005427. https://doi.org/10.1136/bmjgh-2021-005427
Moore, P. L., & Baden, L. R. (2022). Omicron—Decoupling Infection from Severe Disease. The New England Journal of Medicine, 386(14), 1361–1362. https://doi.org/10.1056/NEJMe2201812
Murphy, W. J., & Longo, D. L. (2022). A Possible Role for Anti-idiotype Antibodies in SARS-CoV-2 Infection and Vaccination. The New England Journal of Medicine, 386(4), 394–396. https://doi.org/10.1056/NEJMcibr2113694
Nasiri, N., Rahmati, S., Etminan, A., Sharifi, H., Bazrafshan, A., Karamouzian, M., & Sharifi, A. (2021). Kidney Complications of COVID-19: A Systematic Review and Meta-Analysis. Journal of Research in Health Sciences, 21(1), e00503. https://doi.org/10.34172/jrhs.2021.39
Nazir, M., Asghar, S., Rathore, M. A., Shahzad, A., Shahid, A., Ashraf Khan, A., Malik, A., Fakhar, T., Kausar, H., & Malik, J. (2022). Menstrual abnormalities after COVID-19 vaccines: A systematic review. Vacunas (English Edition), 23, S77–S87. https://doi.org/10.1016/j.vacune.2022.10.019
Ndeupen, S., Qin, Z., Jacobsen, S., Bouteau, A., Estanbouli, H., & Igyártó, B. Z. (2021). The mRNA-LNP platform’s lipid nanoparticle component used in preclinical vaccine studies is highly inflammatory. iScience, 24(12), 103479. https://doi.org/10.1016/j.isci.2021.103479
Ntziora, F., Kostaki, E. G., Karapanou, A., Mylona, M., Tseti, I., Sipsas, N. V., Paraskevis, D., & Sfikakis, P. P. (2022). Protection of vaccination versus hybrid immunity against infection with COVID-19 Omicron variants among Health-Care Workers. Vaccine, 40(50), 7195–7200. https://doi.org/10.1016/j.vaccine.2022.09.042
Parés-Badell, O., Martínez-Gómez, X., Pinós, L., Borras-Bermejo, B., Uriona, S., Otero-Romero, S., Rodrigo-Pendás, J. Á., Cossio-Gil, Y., Agustí, A., Aguilera, C., & Campins, M. (2021). Local and Systemic Adverse Reactions to mRNA COVID-19 Vaccines Comparing Two Vaccine Types and Occurrence of Previous COVID-19 Infection. Vaccines, 9(12), 1463. https://doi.org/10.3390/vaccines9121463
Patamatamkul, S., & Potongcamphan, M. (2023). Persistently raised blood pressure following coronavirus disease 2019 vaccines: Implication for future systematic research and monitoring. European Journal of Internal Medicine. https://doi.org/10.1016/j.ejim.2023.07.006
Patel, H., Sintou, A., Chowdhury, R. A., Rothery, S., Iacob, A. O., Prasad, S., Rainer, P. P., Martinón-Torres, F., Sancho-Shimizu, V., Shimizu, C., Dummer, K., Tremoulet, A. H., Burns, J. C., Sattler, S., Levin, M., & DIAMONDS consortium. (2023). Evaluation of Autoantibody Binding to Cardiac Tissue in Multisystem Inflammatory Syndrome in Children and COVID-19 Vaccination–Induced Myocarditis. JAMA Network Open, 6(5), e2314291. https://doi.org/10.1001/jamanetworkopen.2023.14291
Paul-Ehrlich-Institut. (2022, September 13). CHMP empfiehlt weitere Zulassungsänderung von Comirnaty (BioNTech/Pfizer) als bivalenten Impfstoff mit Anpassung an die Omikron-Varianten BA.4/BA.5 für Auffrischimpfungen. Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel. https://www.pei.de/DE/newsroom/hp-meldungen/2022/220913-chmp-zulassungsaenderung-comirnaty-omikron-ba4-ba5-auffrischungsimpfungen.html
Paul-Ehrlich-Institut. (2023a). Was wissen wir über die Sicherheit der Lipidnanopartikel in mRNA-Impfstoffen? PEI. https://www.pei.de/SharedDocs/FAQs/DE/coronavirus/sicherheit-wirksamkeit-impfstoff/9-coronavirus-impfstoff-covid-19-sicherheit-lipidnanopartikel-mrna-impfstoffe.html
Paul-Ehrlich-Institut. (2023b, Februar 1). Sicherheit von COVID-19-Impfstoffen. PEI. https://www.pei.de/DE/newsroom/dossier/coronavirus/arzneimittelsicherheit.html
Paul-Ehrlich-Institut. (2023c, März 31). COVID-19-Impfstoffe. PEI. https://www.pei.de/DE/arzneimittel/impfstoffe/covid-19/covid-19-node.html
Paul-Ehrlich-Institut. (2023d, September 1). Meldungen—Zulassung für an Omikron-Variante XBB.1.5 angepassten Impfstoff Comirnaty erfolgt. Newsroom. https://www.pei.de/DE/newsroom/hp-meldungen/2023/230901-zulassung-omikron-xbb-1-5-comirnaty.html?nn=170852
Paul-Ehrlich-Institut. (2023e, September 15). Meldungen—Zulassung für an Omikron-Variante XBB.1.5 angepassten Impfstoff Spikevax erteilt. Newsroom. https://www.pei.de/DE/newsroom/hp-meldungen/2023/230915-zulassung-omikron-xbb-1-5-spikevax.html
Petrelli, F., Oldani, S., Borgonovo, K., Cabiddu, M., Dognini, G., Ghilardi, M., Parati, M. C., Petro’, D., Dottorini, L., Rea, C., Lonati, V., Luciani, A., & Ghidini, A. (2023). Vitamin D3 and COVID-19 Outcomes: An Umbrella Review of Systematic Reviews and Meta-Analyses. Antioxidants, 12(2), Article 2. https://doi.org/10.3390/antiox12020247
Pezzullo, A. M., Axfors, C., Contopoulos-Ioannidis, D. G., Apostolatos, A., & Ioannidis, J. P. A. (2023). Age-stratified infection fatality rate of COVID-19 in the non-elderly population. Environmental Research, 216(Pt 3), 114655. https://doi.org/10.1016/j.envres.2022.114655
Pilz, S., & Ioannidis, J. P. A. (2023). Does natural and hybrid immunity obviate the need for frequent vaccine boosters against SARS-CoV-2 in the endemic phase? European Journal of Clinical Investigation, 53(2), e13906. https://doi.org/10.1111/eci.13906
Pilz, S., Theiler-Schwetz, V., Trummer, C., Krause, R., & Ioannidis, J. P. A. (2022). SARS-CoV-2 reinfections: Overview of efficacy and duration of natural and hybrid immunity. Environmental Research, 209, 112911. https://doi.org/10.1016/j.envres.2022.112911
Pittet, L. F., Messina, N. L., Orsini, F., Moore, C. L., Abruzzo, V., Barry, S., Bonnici, R., Bonten, M., Campbell, J., Croda, J., Dalcolmo, M., Gardiner, K., Gell, G., Germano, S., Gomes-Silva, A., Goodall, C., Gwee, A., Jamieson, T., Jardim, B., … Curtis, N. (2023). Randomized Trial of BCG Vaccine to Protect against Covid-19 in Health Care Workers. New England Journal of Medicine, 388(17), 1582–1596. https://doi.org/10.1056/NEJMoa2212616
Prillaman, M. (2023). Inflammation in severe COVID linked to bad fungal microbiome. Nature. https://doi.org/10.1038/d41586-023-03295-w
Quinn, G. A., Connolly, M., Fenton, N. E., Hatfill, S. J., Hynds, P., ÓhAiseadha, C., Sikora, K., Soon, W., & Connolly, R. (2024). Influence of Seasonality and Public-Health Interventions on the COVID-19 Pandemic in Northern Europe. Journal of Clinical Medicine, 13(2), Article 2. https://doi.org/10.3390/jcm13020334
Ramakrishnan, S., Nicolau, D. V., Langford, B., Mahdi, M., Jeffers, H., Mwasuku, C., Krassowska, K., Fox, R., Binnian, I., Glover, V., Bright, S., Butler, C., Cane, J. L., Halner, A., Matthews, P. C., Donnelly, L. E., Simpson, J. L., Baker, J. R., Fadai, N. T., … Bafadhel, M. (2021). Inhaled budesonide in the treatment of early COVID-19 (STOIC): A phase 2, open-label, randomised controlled trial. The Lancet. Respiratory Medicine, 9(7), 763–772. https://doi.org/10.1016/S2213-2600(21)00160-0
Rasmussen, M., Møller, F. T., Gunalan, V., Baig, S., Bennedbæk, M., Christiansen, L. E., Cohen, A. S., Ellegaard, K., Fomsgaard, A., Franck, K. T., Larsen, N. B., Larsen, T. G., Lassaunière, R., Polacek, C., Qvesel, A. G., Sieber, R. N., Rasmussen, L. D., Stegger, M., Spiess, K., … Jokelainen, P. (2023). First cases of SARS-CoV-2 BA.2.86 in Denmark, 2023. Eurosurveillance, 28(36), 2300460. https://doi.org/10.2807/1560-7917.ES.2023.28.36.2300460
Reme, B.-A., Gjesvik, J., & Magnusson, K. (2023). Predictors of the post-COVID condition following mild SARS-CoV-2 infection. Nature Communications, 14(1), Article 1. https://doi.org/10.1038/s41467-023-41541-x
Reusch, J., Wagenhäuser, I., Gabel, A., Höhn, A., Lâm, T.-T., Krone, L. B., Frey, A., Schubert-Unkmeir, A., Dölken, L., Frantz, S., Kurzai, O., Vogel, U., Krone, M., & Petri, N. (2023). Inability to work following COVID-19 vaccination–a relevant aspect for future booster vaccinations. Public Health, 222, 186–195. https://doi.org/10.1016/j.puhe.2023.07.008
Richter, E., Liebl, D., Schulte, B., Lehmann, N., Fuhrmann, C., Jöckel, K.-H., Ioannidis, J. P. A., & Streeck, H. (2023). Analysis of fatality impact and seroprevalence surveys in a community sustaining a SARS-CoV-2 superspreading event. Scientific Reports, 13(1), Article 1. https://doi.org/10.1038/s41598-023-32441-7
Robert Koch-Institut. (2021, November 26). Epidemiologischer Steckbrief zu SARS-CoV-2 und COVID-19. Infektionskrankheiten A-Z. https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Steckbrief.
Robert Koch-Institut. (2022a). Wöchentlicher Lagebericht des RKI zur Coronavirus-Krankheit-2019 (COVID-19): 23.06.2022 – Aktualisierter Stand für Deutschland (Situationsbericht 23.06.2022). RKI. https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Situationsberichte/Wochenbericht/Wochenbericht_2022-06-23.pdf?__blob=publicationFile
Robert Koch-Institut. (2022b). Wöchentlicher Lagebericht des RKI zur Coronavirus-Krankheit-2019 (COVID-19): 21.07.2022 – Aktualisierter Stand für Deutschland (Situationsbericht 21.07.2022). RKI. https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Situationsberichte/Wochenbericht/Wochenbericht_2022-07-21.pdf?__blob=publicationFile
Robert Koch-Institut. (2023a, Februar 9). AUFKLÄRUNGSMERKBLATT Schutzimpfung (Grundimmunisierung und Auffrischimpfungen) gegen COVID-19 (Corona Virus Disease 2019). RKI. https://www.rki.de/DE/Content/Infekt/Impfen/Materialien/Downloads-COVID-19/Aufklaerungsbogen-de.pdf?__blob=publicationFile
Robert Koch-Institut. (2023b). Wöchentlicher Lagebericht des RKI zur Coronavirus-Krankheit-2019 (COVID-19): 23.03.2023 – Aktualisierter Stand für Deutschland (Situationsbericht 23.03.2023). RKI. https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Situationsberichte/Wochenbericht/Wochenbericht_2023-03-23.pdf?__blob=publicationFile
Robert Koch-Institut. (2023c, März 28). Impfung bei Kindern und Jugendlichen. RKI. https://www.rki.de/SharedDocs/FAQ/COVID-Impfen/FAQ_Liste_Impfung_Kinder_Jugendliche.html
Robert Koch-Institut. (2023d, Mai 25). Epidemiologisches Bulletin 21/2023 (Nr. 21/2023). Implementierung der COVID-19-Impfung in die allgemeinen Empfehlungen der STIKO 2023. https://www.rki.de/DE/Content/Infekt/EpidBull/Archiv/2023/Ausgaben/21_23.pdf?__blob=publicationFile
Robert Koch-Institut. (2023e). ARE-Wochenbericht des RKI 36/2023. influenza.rki.de, 36, 3. https://doi.org/10.25646/11697
Robert Koch-Institut. (2023f, September 18). Stellungnahme der STIKO anlässlich der Zulassung von XBB.1.5-Varianten-adaptierten COVID-19-Impfstoffen für die Auffrischimpfung von Personen mit erhöhtem Risiko für einen schweren Krankheitsverlauf. Ständige Impfkommission. https://www.rki.de/DE/Content/Kommissionen/STIKO/Empfehlungen/Stellungnahme-COVID-19-Varianten-adaptierte-Impfstoffe.html
Robert Koch-Institut. (2023g). Wöchentlicher Lagebericht des RKI zur Coronavirus-Krankheit-2019 (COVID-19): 08.06.2023 – Aktualisierter Stand für Deutschland (Situationsbericht 08.06.2023; Aktualisierter Stand für Deutschland). RKI. https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Situationsberichte/Wochenbericht/Wochenbericht_2023-06-08.pdf?__blob=publicationFile
Robert Koch-Institut. (2024, Januar 11). COVID-19-Impfempfehlung. Infektionsschutz. https://www.rki.de/SharedDocs/FAQ/COVID-Impfen/FAQ_Liste_STIKO_Empfehlungen.html
Sabaghian, T., Kharazmi, A. B., Ansari, A., Omidi, F., Kazemi, S. N., Hajikhani, B., Vaziri-Harami, R., Tajbakhsh, A., Omidi, S., Haddadi, S., Shahidi Bonjar, A. H., Nasiri, M. J., & Mirsaeidi, M. (2022). COVID-19 and Acute Kidney Injury: A Systematic Review. Frontiers in Medicine, 9, 705908. https://doi.org/10.3389/fmed.2022.705908
Scheibenbogen, C., Renz-Polster, H., Hohberger, B., Behrends, U., Schieffer, E., & Schieffer, B. (2023, März 31). Post COVID und Post-Vakzin-Syndrom: Die Pandemie nach der Pandemie. Deutsches Ärzteblatt. https://www.aerzteblatt.de/archiv/230502/Post-COVID-und-Post-Vakzin-Syndrom-Die-Pandemie-nach-der-Pandemie
Schroth, D., Garg, R., Bocova, X., Hansmann, J., Haass, M., Yan, A., Fernando, C., Chacko, B., Oikonomou, A., White, J., Alhussein, M. M., Giusca, S., Ochs, A., Korosoglou, G., André, F., Friedrich, M. G., & Ochs, M. (2023). Predictors of persistent symptoms after mRNA SARS-CoV-2 vaccine-related myocarditis (myovacc registry). Frontiers in Cardiovascular Medicine, 10, 1204232. https://doi.org/10.3389/fcvm.2023.1204232
Schuchmann, P., Scheuch, G., Naumann, R., Keute, M., Lücke, T., Zielen, S., & Brinkmann, F. (2023). Exhaled aerosols among PCR-confirmed SARS-CoV-2-infected children. Frontiers in Pediatrics, 11. https://www.frontiersin.org/articles/10.3389/fped.2023.1156366
Schumann, D. F., & Erdmann, E. (2023, Juni 15). Corona-Impfschäden: Einer von 10.000 Geimpften will einen Impfschaden anerkennen lassen. Die Zeit. https://www.zeit.de/gesundheit/2023-06/impfschaeden-corona-herzmuskelentzuendung-antrag
Schumann, F., & Wüstenhagen, C. (2023, Juni 12). Corona-Impfschäden: „Um einen Impfschaden anzuerkennen, brauchen wir drei Tatbestände“. Die Zeit. https://www.zeit.de/gesundheit/2023-06/corona-impfschaeden-hersteller-schadensersatz-myokarditis-post-vac
Schwarz, S., Jenetzky, E., Krafft, H., Maurer, T., Steuber, C., Reckert, T., Fischbach, T., & Martin, D. (2021). [Corona in Children: The Co-Ki Study]. Monatsschrift Kinderheilkunde: Organ Der Deutschen Gesellschaft Fur Kinderheilkunde, 169(1), 39–45. https://doi.org/10.1007/s00112-020-01050-3
Selvakumar, J., Havdal, L. B., Drevvatne, M., Brodwall, E. M., Lund Berven, L., Stiansen-Sonerud, T., Einvik, G., Leegaard, T. M., Tjade, T., Michelsen, A. E., Mollnes, T. E., Lund-Johansen, F., Holmøy, T., Zetterberg, H., Blennow, K., Sandler, C. X., Cvejic, E., Lloyd, A. R., & Wyller, V. B. B. (2023). Prevalence and Characteristics Associated With Post-COVID-19 Condition Among Nonhospitalized Adolescents and Young Adults. JAMA Network Open, 6(3), e235763. https://doi.org/10.1001/jamanetworkopen.2023.5763
Semmler, A., Mundorf, A. K., Kuechler, A. S., Schulze-Bosse, K., Heidecke, H., Schulze-Forster, K., Schott, M., Uhrberg, M., Weinhold, S., Lackner, K. J., Pawlitzki, M., Meuth, S. G., Boege, F., & Ruhrländer, J. (2023). Chronic Fatigue and Dis-Autonomy following COVID-19 Vaccination is Distinguished from Normal Vaccination Response by Altered Blood Markers (2023090113). Preprints. https://doi.org/10.20944/preprints202309.0113.v1
Shang, W., Kang, L., Cao, G., Wang, Y., Gao, P., Liu, J., & Liu, M. (2022). Percentage of Asymptomatic Infections among SARS-CoV-2 Omicron Variant-Positive Individuals: A Systematic Review and Meta-Analysis. Vaccines, 10(7), 1049. https://doi.org/10.3390/vaccines10071049
Shoar, S., Hosseini, F., Naderan, M., & Mehta, J. L. (2020). Meta-analysis of Cardiovascular Events and Related Biomarkers Comparing Survivors Versus Non-survivors in Patients With COVID-19. The American Journal of Cardiology, 135, 50–61. https://doi.org/10.1016/j.amjcard.2020.08.044
Shrestha, N. K., Burke, P. C., Nowacki, A. S., Simon, J. F., Hagen, A., & Gordon, S. M. (2023). Effectiveness of the Coronavirus Disease 2019 (COVID-19) Bivalent Vaccine. Open Forum Infectious Diseases, ofad209. https://doi.org/10.1093/ofid/ofad209
Sievers, C., Zacher, B., Ullrich, A., Huska, M., Fuchs, S., Buda, S., Haas, W., Diercke, M., An der Heiden, M., & Kröger, S. (2022). SARS-CoV-2 Omicron variants BA.1 and BA.2 both show similarly reduced disease severity of COVID-19 compared to Delta, Germany, 2021 to 2022. Euro Surveillance: Bulletin Europeen Sur Les Maladies Transmissibles = European Communicable Disease Bulletin, 27(22), 2200396. https://doi.org/10.2807/1560-7917.ES.2022.27.22.2200396
Singh, J., Malik, P., Patel, N., Pothuru, S., Israni, A., Chakinala, R. C., Hussain, M. R., Chidharla, A., Patel, H., Patel, S. K., Rabbani, R., Patel, U., Chugh, S., & Kichloo, A. (2022). Kidney disease and COVID-19 disease severity-systematic review and meta-analysis. Clinical and Experimental Medicine, 22(1), 125–135. https://doi.org/10.1007/s10238-021-00715-x
Spinardi, J. R., & Srivastava, A. (2023). Hybrid Immunity to SARS-CoV-2 from Infection and Vaccination-Evidence Synthesis and Implications for New COVID-19 Vaccines. Biomedicines, 11(2), 370. https://doi.org/10.3390/biomedicines11020370
Stein, C., Nassereldine, H., Sorensen, R. J. D., Amlag, J. O., Bisignano, C., Byrne, S., Castro, E., Coberly, K., Collins, J. K., Dalos, J., Daoud, F., Deen, A., Gakidou, E., Giles, J. R., Hulland, E. N., Huntley, B. M., Kinzel, K. E., Lozano, R., Mokdad, A. H., … Lim, S. S. (2023). Past SARS-CoV-2 infection protection against re-infection: A systematic review and meta-analysis. The Lancet, 401(10379), 833–842. https://doi.org/10.1016/S0140-6736(22)02465-5
Stephenson, T., Shafran, R., & Ladhani, S. N. (2022). Long COVID in children and adolescents. Current Opinion in Infectious Diseases, 35(5), 461–467. https://doi.org/10.1097/QCO.0000000000000854
Streeck, H., Schulte, B., Kümmerer, B. M., Richter, E., Höller, T., Fuhrmann, C., Bartok, E., Dolscheid-Pommerich, R., Berger, M., Wessendorf, L., Eschbach-Bludau, M., Kellings, A., Schwaiger, A., Coenen, M., Hoffmann, P., Stoffel-Wagner, B., Nöthen, M. M., Eis-Hübinger, A. M., Exner, M., … Hartmann, G. (2020). Infection fatality rate of SARS-CoV2 in a super-spreading event in Germany. Nature Communications, 11(1), 5829. https://doi.org/10.1038/s41467-020-19509-y
Tagesschau (2022, Mai 3). Viele Erwachsene in Europa sind zu dick. tagesschau.de. https://www.tagesschau.de/ausland/europa/who-europa-gewicht-101.html
Takefuji, Y. (2023). Impact of COVID-19 on mortality under 5 years old. Pediatric Research, 1–1. https://doi.org/10.1038/s41390-023-02612-3
Tan, L. Y., Komarasamy, T. V., & Rmt Balasubramaniam, V. (2021). Hyperinflammatory Immune Response and COVID-19: A Double Edged Sword. Frontiers in Immunology, 12, 742941. https://doi.org/10.3389/fimmu.2021.742941
Teshome, A., Adane, A., Girma, B., & Mekonnen, Z. A. (2021). The Impact of Vitamin D Level on COVID-19 Infection: Systematic Review and Meta-Analysis. Frontiers in Public Health, 9, 624559. https://doi.org/10.3389/fpubh.2021.624559
Tokumasu, K., Fujita-Yamashita, M., Sunada, N., Sakurada, Y., Yamamoto, K., Nakano, Y., Matsuda, Y., Otsuka, Y., Hasegawa, T., Hagiya, H., Honda, H., & Otsuka, F. (2023). Characteristics of Persistent Symptoms Manifested after SARS-CoV-2 Vaccination: An Observational Retrospective Study in a Specialized Clinic for Vaccination-Related Adverse Events. Vaccines, 11(11), 1661. https://doi.org/10.3390/vaccines11111661
Tsilingiris, D., Vallianou, N. G., Karampela, I., Liu, J., & Dalamaga, M. (2022). Potential implications of lipid nanoparticles in the pathogenesis of myocarditis associated with the use of mRNA vaccines against SARS-CoV-2. Metabolism Open, 13, 100159. https://doi.org/10.1016/j.metop.2021.100159
Tuvali, O., Tshori, S., Derazne, E., Hannuna, R. R., Afek, A., Haberman, D., Sella, G., & George, J. (2022). The Incidence of Myocarditis and Pericarditis in Post COVID-19 Unvaccinated Patients—A Large Population-Based Study. Journal of Clinical Medicine, 11(8), Article 8. https://doi.org/10.3390/jcm11082219
Uversky, V. N., Redwan, E. M., Makis, W., & Rubio-Casillas, A. (2023). IgG4 Antibodies Induced by Repeated Vaccination May Generate Immune Tolerance to the SARS-CoV-2 Spike Protein. Vaccines, 11(5), Article 5. https://doi.org/10.3390/vaccines11050991
U.S. Department of Health & Human Services. (2023). Electronic Support for Public Health—Vaccine Adverse Event Reporting System (ESP:VAERS) | Digital Healthcare Research. Digital Healthcare Research. https://digital.ahrq.gov/ahrq-funded-projects/electronic-support-public-health-vaccine-adverse-event-reporting-system
Vivaldi, G., Pfeffer, P. E., Talaei, M., Basera, T. J., Shaheen, S. O., & Martineau, A. R. (2023). Long-term symptom profiles after COVID-19 vs other acute respiratory infections: An analysis of data from the COVIDENCE UK study. eClinicalMedicine, 65. https://doi.org/10.1016/j.eclinm.2023.102251
Voleti, N., Reddy, S. P., & Ssentongo, P. (2022). Myocarditis in SARS-CoV-2 infection vs. COVID-19 vaccination: A systematic review and meta-analysis. Frontiers in Cardiovascular Medicine, 9, 951314. https://doi.org/10.3389/fcvm.2022.951314
Wang, Z., Joshi, A., Leopold, K., Jackson, S., Christensen, S., Nayfeh, T., Mohammed, K., Creo, A., Tebben, P., & Kumar, S. (2022). Association of vitamin D deficiency with COVID-19 infection severity: Systematic review and meta-analysis. Clinical Endocrinology, 96(3), 281–287. https://doi.org/10.1111/cen.14540
Wang, Q., Bowen, A., Ho, J., Zhang, R., Valdez, R., Stoneman, E., Gordon, A., Liu, L., & Ho, D. D. (2023a). SARS-CoV-2 Neutralizing Antibodies Following a Second BA.5 Bivalent Booster (S. 2023.08.13.553148). bioRxiv. https://doi.org/10.1101/2023.08.13.553148
Wang, Q., Bowen, A., Valdez, R., Gherasim, C., Gordon, A., Liu, L., & Ho, D. D. (2023b). Antibody Response to Omicron BA.4–BA.5 Bivalent Booster. The New England Journal of Medicine, NEJMc2213907. https://doi.org/10.1056/NEJMc2213907
Washrawirul, C., Triwatcharikorn, J., Phannajit, J., Ullman, M., Susantitaphong, P., & Rerknimitr, P. (2022). Global prevalence and clinical manifestations of cutaneous adverse reactions following COVID-19 vaccination: A systematic review and meta-analysis. Journal of the European Academy of Dermatology and Venereology: JEADV, 36(11), 1947–1968. https://doi.org/10.1111/jdv.18294
Westphal, T., Mader, M., Karsten, H., Cords, L., Knapp, M., Schulte, S., Hermanussen, L., Peine, S., Ditt, V., Grifoni, A., Addo, M. M., Huber, S., Sette, A., Lütgehetmann, M., Pischke, S., Kwok, W. W., Sidney, J., & Schulze zur Wiesch, J. (2023). Evidence for broad cross-reactivity of the SARS-CoV-2 NSP12-directed CD4+ T-cell response with pre-primed responses directed against common cold coronaviruses. Frontiers in Immunology, 14. https://www.frontiersin.org/articles/10.3389/fimmu.2023.1182504
Wissenschaftliches Institut der AOK. (2023, März 16). Post-Covid-Erkrankungen: Wenige Betroffene, aber lange Ausfallzeiten. WIdO. https://www.wido.de/news-presse/pressemitteilungen/2023/post-covid-erkrankungen/
World Health Organization. (2022a). WHO Pharmaceuticals Newsletter 01/2022. WHO. https://apps.who.int/iris/bitstream/handle/10665/351326/9789240042452-eng.pdf?sequence=1&isAllowed=y
World Health Organization. (2022b). WHO Pharmaceuticals Newsletter 03/2022. WHO. https://apps.who.int/iris/bitstream/handle/10665/351326/9789240042452-eng.pdf?sequence=1&isAllowed=y
World Health Organization. (2023a, Januar 30). Statement on the fourteenth meeting of the International Health Regulations (2005) Emergency Committee regarding the coronavirus disease (COVID-19) pandemic. WHO. https://www.who.int/news/item/30-01-2023-statement-on-the-fourteenth-meeting-of-the-international-health-regulations-(2005)-emergency-committee-regarding-the-coronavirus-disease-(covid-19)-pandemic
World Health Organization. (2023b, März 28). SAGE updates COVID-19 vaccination guidance. WHO. https://www.who.int/news/item/28-03-2023-sage-updates-covid-19-vaccination-guidance
Wu, Y., Kang, L., Guo, Z., Liu, J., Liu, M., & Liang, W. (2022). Incubation Period of COVID-19 Caused by Unique SARS-CoV-2 Strains: A Systematic Review and Meta-analysis. JAMA Network Open, 5(8), e2228008. https://doi.org/10.1001/jamanetworkopen.2022.28008
Yu, W., Guo, Y., Zhang, S., Kong, Y., Shen, Z., & Zhang, J. (2022). Proportion of asymptomatic infection and nonsevere disease caused by SARS-CoV-2 Omicron variant: A systematic review and analysis. Journal of Medical Virology, 94(12), 5790–5801. https://doi.org/10.1002/jmv.28066
Xie, Y., Xu, J., Zhou, D., Guo, M., Zhang, M., Gao, Y., Liu, M., Shi, J., Yang, K., Zheng, Q., Zhao, L., Qin, Y., Hu, R., Wei, J., Zhang, J., & Tian, J. (2023). Micronutrient perspective on COVID-19: Umbrella review and reanalysis of meta-analyses. Critical Reviews in Food Science and Nutrition, 1–19. https://doi.org/10.1080/10408398.2023.2174948
zdfheute. (2021, November 11). Impfung gegen Corona: Noch nicht genug aufgeklärt? zdf.de. https://www.zdf.de/uri/471da2a5-a8a3-41cc-886e-571bbf7d5b0a
Zhao, Y.-H., Zhao, L., Yang, X.-C., & Wang, P. (2021). Cardiovascular complications of SARS-CoV-2 infection (COVID-19): A systematic review and meta-analysis. Reviews in Cardiovascular Medicine, 22(1), 159–165. https://doi.org/10.31083/j.rcm.2021.01.238
Zuin, M., Rigatelli, G., Zuliani, G., & Roncon, L. (2021). The risk of thrombosis after acute-COVID-19 infection. QJM: Monthly Journal of the Association of Physicians, 114(9), 619–620. https://doi.org/10.1093/qjmed/hcab054
Stand: 21. Februar 2024
Nächste Aktualisierung: 25. Juli 2024